微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室用硫酸铵、硫酸和废铁屑制备硫酸亚铁铵晶体的方法如下:
步骤1:将废铁屑依次用热的碳酸钠溶液、蒸馏水洗涤。
步骤2:向盛有洁净铁屑的烧杯中加入稀H2SO4溶液,水浴加热,使铁屑与稀硫酸反应至基本不再冒出气泡为止。趋热过滤。
步骤3:向滤液中加入一定量(NH4)2SO4固体。
硫酸亚铁晶体、硫酸铵、硫酸亚铁铵晶体的溶解度(g/100 g H2O)
温度物理溶解度
| 0 ℃
| 10 ℃
| 20 ℃
| 30 ℃
| 40 ℃
| 50 ℃
| 60 ℃
|
FeSO4·7H2O
| 15.6
| 20.5
| 26.5
| 32.9
| 40.2
| 48.6
| -
|
(NH4)2SO4
| 70.6
| 73.0
| 75.4
| 78.0
| 81.0
| -
| 88.0
|
(NH4)2SO4·FeSO4·6H2O
| 12.5
| 17.2
| 21.0
| 28.1
| 33.0
| 40.0
| 44.6
|
?
(1)步骤2中控制生成的硫酸亚铁中不含硫酸铁的方法是______________。
(2)在0~60 ℃内,从硫酸亚铁和硫酸铵的混合溶液中可获得硫酸亚铁铵晶体的原因是_______________________________________________________。
(3)为了从步骤3所得溶液中获得硫酸亚铁铵晶体,操作是___________________________。
(4)测定硫酸亚铁铵晶体中Fe2+含量的步骤如下:
步骤1:准确称取a g(约为0.5 g)硫酸亚铁铵晶体样品,并配制成100 mL溶液。
步骤2:准确移取25.00 mL硫酸亚铁铵溶液于250 mL锥形瓶中。
步骤3:立即用浓度约为0.1 mol·L-1 KMnO4溶液滴定至溶液呈稳定的粉红色,即为滴定终点。
步骤4:将实验步骤1~3重复2次。
①步骤1中配制100 mL溶液需要的玻璃仪器是___________________________________;
②为获得样品中Fe2+的含量,还需补充的实验是_________________________________。
参考答案:(1)保持铁过量
(2)在0~60 ℃范围内,同一温度下硫酸亚铁铵晶体的溶解度最小
(3)蒸发浓缩、冷却结晶、过滤、冰水洗涤、干燥
(4)①玻璃棒、100 mL容量瓶、胶头滴管、烧杯
②准确测定KMnO4溶液的物质的量浓度
本题解析:(1)考虑到2Fe3++Fe=3Fe2+,使Fe过量可控制不生成硫酸铁。(2)在0~60 ℃范围内,硫酸亚铁铵晶体的溶解度比硫酸亚铁和硫酸铵小。(3)蒸发浓缩,冷却结晶,过滤后得到硫酸亚铁铵晶体,此时硫酸亚铁和硫酸铵都没有析出,可用水洗去表面的杂质,冰水是为了减少硫酸亚铁铵晶体的溶解损失。(4)①考查配制一定物质的量浓度溶液的操作和仪器的选择,注意容量瓶要指明规格。②步骤3中KMnO4溶液的浓度约为0.1 mol·L-1,无法定量计算,故需准确测定KMnO4溶液的物质的量浓度。
本题难度:一般
2、选择题 下列除去括号内杂质方法正确的是
A.HCl(Cl2)混和气通过CCl4 ,洗气
B.MgCl2溶液(FeCl3溶液)过量Mg粉,过滤
C.硝基苯(苯)蒸馏水使混合液体分层,分液
D.乙烷(乙烯)通过H2加成的方法
参考答案:A
本题解析:选项B中MgCl2溶液中除去FeCl3溶液常选用Mg(OH)2。选项C中硝基苯和苯都是有机物,水是无机物,根据相似相溶原理,蒸馏水不能使混合液分层。选项D中用H2除杂会引入新的杂质气体H2。
点评:本题需要对化学物质的除杂方法的进行选择,学生要对各种物质的性质以及常用的化学除杂方法掌握良好,并对每一种化学方法的除杂要有自己的评价,有优有劣,才能比较出比较好的方法,对题目中不好的方法也要能说出哪里不好。
本题难度:简单
3、选择题 某溶液仅含Fe2+、Na+、Al3+、Ba2+、S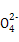 、N
、N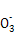 、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是(? )
、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是(? )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72 g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
参考答案:A
本题解析:向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变,说明溶液中含有Fe2+、NO3-、SO42-,根据电荷守恒可知,溶液中还含有Na+。向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得的物质是Fe2O3,其质量为80 g,故A项错。
本题难度:一般
4、实验题 (7分)某学生用下图的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。

(1)甲瓶内盛??溶液,乙瓶内盛?溶液,分液漏斗内盛?溶液。
(2)实验先分离出一氧化碳,方法是先关闭?,再打开?。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭?,再打开?。
参考答案:

本题解析:(1)CO为非成盐氧化物,而二氧化碳为酸性氧化物,所以,甲瓶内盛氢氧化钠溶液可吸收二氧化碳气体生成碳酸钠,乙瓶内盛浓硫酸可干燥CO气体,分液漏斗内盛浓硫酸,将碳酸钠转化成二氧化碳气体;
(2)实验先分离出一氧化碳,方法是先关闭b,再打开a
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭a,再打开b
本题难度:一般
5、选择题 下列溶液中离子的检验方法和结论相符的一组是
序号
| 检验方法
| 结论
|
A
| 向一种未知溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成
| 未知溶液中一定含有SO42—
|
B
| 向一种未知溶液中滴加NaOH溶液,产生白色沉淀
| 未知溶液中一定含有Al3+
|
C
| 向一种未知溶液中加入盐酸酸化的 AgNO3溶液,有白色沉淀生成
| 未知溶液中一定含有Cl—
|
D
| 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体
| 不能确定未知溶液中一定含有CO32—
|
?
参考答案:D
本题解析:A、向一种未知溶液中加入硝酸酸化的BaCl2溶液,未知溶液中含有SO42—或Ag+,都有白色沉淀生成,A错误;B 、溶液中有Al3+、Mg2+滴加NaOH溶液,都产生白色沉淀,故B错误;C、向一种未知溶液中加入盐酸酸化的 AgNO3溶液,有白色沉淀生成,中间过程引入了Cl—,不能确定原溶液中是否有Cl—,C错误;D、向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体,不能确定未知溶液中一定含有CO32—,正确。
本题难度:一般