微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列属于氧化还原反应的是
A.CO2+H2O=H2CO3
B.H2CO3=CO2↑+H2O
C.2NaOH+H2SO4=Na2SO4+2H2O
D.C+O2 CO2
CO2
参考答案:D
本题解析:略
本题难度:简单
2、选择题 正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
A.乙烯的结构简式为CH2CH2
B.乙醇的结构简式为C2H6O
C.丙烷的实验式为 C3H8
D.羟基的电子式: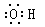
参考答案:C
本题解析:A.乙烯的结构简式为CH2=CH2; B.乙醇的结构简式为CH3CH2OH;C. 丙烷的实验式为 C3H8;D. 羟基的电子式: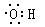 ,故选C。
,故选C。
点评:此题是高考的常考题型,题目交易,要求学生能熟练掌握基本的化学用语。
本题难度:一般
3、选择题 在下列变化中,按氮元素被还原、被氧化、既被氧化又被还原、既不被氧化又不被还原的顺序排列正确的是?①大气通过闪电固氮?②硝酸分解?③实验室用氯化铵和消石制取氨气?④二氧化氮溶于水中
A.①②③④
B.②④①③
C.①③④②
D.②①④③
参考答案:D
本题解析:①氮元素由单质被氧化为化合物,故氮元素被氧化。②硝酸分解,化合价降低,被还原。③实验室用氯化铵和消石制取氨气,氮元素化合价未发生变化,既不被氧化又不被还原。④二氧化氮溶于水产物为硝酸与一氧化氮,故既被氧化又被还原。故答案选择D选项。
本题难度:一般
4、选择题 下列气体溶于水发生氧化还原反应的是
A.SO2 溶于水
B.NO2 溶于水
C.CO2 溶于水
D.NH3 溶于水
参考答案:B
本题解析:略
本题难度:简单
5、填空题 为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
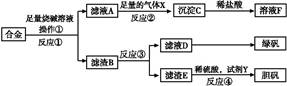
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号
| ①
| ②
| ③
| ④
|
稀硝酸体积(mL)
| 100
| 200
| 300
| 400
|
剩余金属质量(g)
| 9.0
| 4.8
| 0
| 0
|
NO体积(L)
| 1.12
| 2.24
| 3.36
| V
|
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
参考答案:(1)烧杯、漏斗、玻璃棒
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)取少量滤液D加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色最后变成红褐色(合理即可)
(4)Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O(或Cu+H2O2+H2SO4=CuSO4+2H2O)
(5)铁粉与杂质铜形成原电池,加快了反应速率 因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O 晶体
(6)2 mol/L 4.8 g 4.48
本题解析:(1)操作①是过滤。(2)金属中只有铝能和氢氧化钠溶液反应生成AlO2-, AlO2-和足量CO2生成Al(OH)3沉淀和HCO3-。(3)滤液D中含有Fe2+,可以利用其和碱生成沉淀时的颜色变化、自身不能使KSCN溶液变红而氧化后变红的性质进行检验。(4)H2O2是绿色氧化剂,还原产物是H2O。(5)里面有杂质铜,形成原电池,加快了反应速率;Fe3+很易发生水解。(6)滤渣B中含有Fe和Cu,分析实验①到②和②到③的过程可知:①到②时,金属过量,硝酸完全反应,100 mL HNO3共产生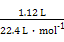 ="0.05" mol NO,消耗金属4.2 g,由反应:
="0.05" mol NO,消耗金属4.2 g,由反应:
3Fe + 8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
3×56 g 8 mol 2 mol
4.2 g 0.2 mol 0.05 mol
知:消耗的4.2 g金属恰好为Fe,且可推知①中消耗的也为Fe且质量为4.2 g,同时求得HNO3的浓度为: ="2" mol·L-1。又由反应:
="2" mol·L-1。又由反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3×64 g 2 mol
m(Cu) 0.05 mol
得:m(Cu)=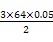 g="4.8" g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应:
g="4.8" g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应:
3Fe2+ + 4H+ + NO3-=3Fe3++NO↑+2H2O
3 mol 4 mol 1 mol 22.4 L
0.15 mol 0.2 mol0.2 mol V′
即V′= ="1.12" L。
="1.12" L。
故V=3.36+1.12=4.48。
本题难度:困难