微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关SO2说法错误的是(?)
A.单质硫在空气中燃烧可生成SO2
B.SO2能使品红溶液褪色是因为它具漂白性,加热可恢复原本红色
C.SO2和Cl2都具有漂白作用,所以将两种气体等物质的量同时作用于潮湿有色物,可增强漂白作用
D.SO2能使加酚酞的NaOH溶液褪色是因为它能与NaOH反应
参考答案:C
本题解析:B项由于二氧化硫的漂白是暂时性漂白,漂白以后生成的无色物质不稳定,受热又能恢复,B项正确;C项由于SO2+ Cl2+2H2O=H2SO4+2HCl,不但没有增强反而减弱漂白性,C项错误;D二氧化硫是酸性氧化物所以能和碱溶液反应。
本题难度:一般
2、选择题 将a mol FeCl3和b mol FeS混合物加入到某浓度的氢硫酸中,充分反应后,氢硫酸的浓度没有改变(不考虑溶液体积的变化),则a、b的关系是(?)
A.a>2b
B.a="b"
C.a≤ 2b
D.a ≥b
参考答案:C
本题解析:略
本题难度:简单
3、选择题 有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是(? )
途径①? S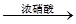 ?H2SO4
?H2SO4
途径②?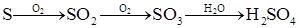
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
参考答案:A
本题解析:途径①反应的化学方程式可表示为S+6HNO3(浓)=H2SO4+6NO2↑+2H2O,属于浓硝酸和非金属单质的反应,产物中无盐生成,因此浓硝酸只表现氧化性而不表现酸性,A错。
本题难度:一般
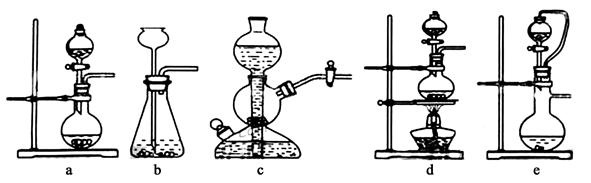
4、实验题 Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,下图中可选用的发生装置是 ??(填写字母)。
Ⅱ.A图表示某学生对SO2与漂粉精[80%Ca(ClO)2)]的反应进行实验探究的过程,观察到的现象有:
①.液面上方出现白雾;
②稍后,出现浑浊,溶液变为黄绿色;
③稍后,产生大量白色沉淀,黄绿色褪去
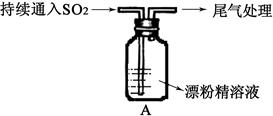
(1)向水中持续通入SO2,未观察到白雾。推测现象①中的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
由实验a、b不能判断白雾中含有HCl,理由是?。
(2)③中大量白色沉淀的成份是?。
(3)现象②中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应产生了Cl2。通过进一步实验确认了这种可能性,其实验方案是??。
(4)用离子方程式解释现象③中黄绿色褪去的原因:?。
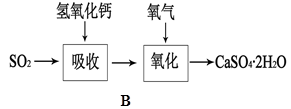
(5)B图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式。
?。
参考答案:Ⅰ.ae (2分)
Ⅱ.⑴ 白雾中含有SO2也能与酸化的AgNO3反应生成白色沉淀(2分)
⑵CaSO4 (2分)
⑶可取适量原溶液加入一定量的稀硫酸观察到溶液变黄绿色(2分)
⑷ Cl2+SO2+2H2O=4H++2Cl-+SO42-? (2分)
⑸ SO2+Ca(OH)2=CaSO3↓+H2O ,2CaSO3+O2+4H2O=2{CaSO4·2H2O。}(2分)
本题解析:Ⅰ.用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置bc。故可选用的发生装置是ae。Ⅱ若白雾中含有SO2,也能与酸化的AgNO3反应生成白色硫酸银沉淀。SO2,也被氧化为硫酸,硫酸和次氯酸钙发生复分解反应生成磷酸钙白色沉淀。可取适量原溶液加入一定量的稀硫酸,Cl-、ClO-、H+发生归中反应得到黄绿色氯气,而使溶液变黄绿色。有氧化性Cl2和还原性的有SO2在水溶液中发生氧化还原反应生成硫酸和盐酸,从而失去氯气的黄绿色。Cl2+SO2+2H2O=4H++2Cl-+SO42-。石灰-石膏法吸收SO2的的化学方程式SO2+Ca(OH)2=CaSO3↓+H2O ,2CaSO3+O2+4H2O=2{CaSO4·2H2O}。2危害,变废为宝。
本题难度:一般
5、选择题 下列实验报告记录的实验现象正确的是? ( )
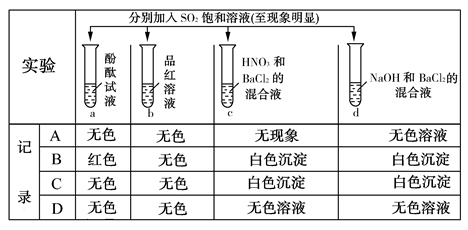
参考答案:C
本题解析:SO2水溶液呈酸性,加入酚酞试液中无明显现象。加入品红溶液中,品红褪色;C中SO2被硝酸氧化成SO42—生成白色硫酸钡沉淀,D中SO2与氢氧化钠反应生成Na2SO3,Na2SO3与BaCl2反应生成BaSO3白色沉淀。
本题难度:一般