微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成
CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________________________。
(2)判断滴定终点的方法是________________________。
(3)计算:血液中含钙离子的浓度为________g·mL-1。
参考答案:(1)2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
(2)当滴入1滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不退色
(3)1.0×10-4
本题解析:
本题难度:一般
2、实验题 某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.100 0 mol/L和0.0100 0 mol/L的标准盐酸。
②用0.100 0 mol/L的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2,取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00 mL,用0.010 00 mol/L的盐酸滴定,用去盐酸34.80 mL。
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?________;
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯F.胶头滴管 G.玻璃棒
(2)滴定操作中,左手 ________,右手________,眼睛__________________;
(3)Ba(OH)2溶液的物质的量浓度是________;
(4)过滤所得浊液的目的是_______________________________________________________;
(5)此空气样品中含CO2的体积分数为________;
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果________(填“偏大”“偏小”或“无影响”)。
参考答案:(1)BCDEFG
(2)控制活塞 摇动锥形瓶 注视锥形瓶内溶液颜色的变化
(3)0.098 0 mol/L
(4)分离出BaCO3,防止HCl与BaCO3反应
(5)0.025%
(6)偏大
本题解析:
本题难度:一般
3、简答题 由Fe2O3、CuO、A1、C中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
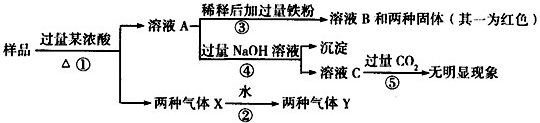
(1)混合气体Y中两种气体的化学式是______,反应①中生成混合气体X的化学方程式是______.
(2)通过上述实验及其现象说明,一定不含有的物质是______,不能确定是否含有的物质是______;
(3)为进一步确定样品中的未知物质,可以用上述反应过程中的溶液,设计一个简单的后续实验就可以确定,方法是:
______.
参考答案:(1)气体X与水反应得Y为两种气体的混合物,则其中一种为NO2,气体Z为NO、CO2混合物,则浓酸为浓硝酸.
反应①中生成混合气体X的化学方程式为C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
故答案为:NO、CO2;C+4HNO3(浓)=CO2↑+4NO2↑+2H2O.
(2)无论加什么浓酸(硫酸和硝酸),溶液A中都可能含有Fe3+、Cu2+、Al3+三种金属阳离子.向溶液A中加入过量的NaOH溶液,可转化为Fe(OH)3和Cu(OH)2沉淀析出,如果有Al3+,则可转化为ALO2-离子,溶液C通入CO2后,会发生反应产生白色沉淀Al(OH)3.
向溶液A中加过量Fe粉,得B溶液和两种固体,且一种固体为红色(Cu),另一种就是过量的Fe粉.
根据上述分析可知,样品中一定没有Al,一定有CuO和C,不能确定是否有Fe2O3.
故答案为:A1;?Fe2O3.
(3)不能确定是否有Fe2O3,若有则溶液A中含有Fe3+,用KSCN溶液检验溶液A中是否含有Fe3+.方法是取溶液A少许,向其中加入KSCN溶液,若溶液变红色,说明样品中含有Fe2O3;若溶液不变红色,说明样品中没有Fe2O3.
故答案为:取溶液A少许,向其中加入KSCN溶液,若溶液变红色,说明样品中含有Fe2O3;若溶液不变红色,说明样品中没有Fe2O3.
本题解析:
本题难度:一般
4、选择题 选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是
[? ]
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
参考答案:B
本题解析:
本题难度:简单
5、选择题 根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
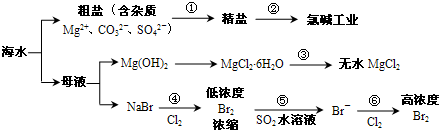
已知:MgCl2?6H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
参考答案:D
本题解析:
本题难度:简单