| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《化学反应与能量》试题巩固(2017年最新版)(六)
参考答案:B 本题解析:A.该反应反应物的能量高于生成物的能量,为放热反应,错误;B.正确;C.CO与水蒸气的反应需在高温下进行,错误;D. 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g) 要吸收41 kJ热量,错误;选B。 本题难度:一般 2、选择题 知反应:A(g)+B(g)=C(g)+D(g)的能量变化如图所示,下列说法正确的是 |
参考答案:B
本题解析:A、该反应是吸热反应,不是自发的氧化还原反应,不能设计成原电池,错误;B、该反应的反应物的总能量低于生成物的总能量,是吸热反应,正确;C、该反应的反应物的总能量低于生成物的总能量,错误;D、吸热反应不一定需要加热条件,放热反应不一定不需要加热条件,反应的热效应与反应条件无关,错误,答案选B。
考点:考查对化学反应热效应的判断
本题难度:一般
3、选择题 已知:(NH4)2CO3(s)====NH4HCO3(s)+NH3(g)? ΔH="+74.9" kJ·mol-1,下列说法中正确的是
A.该反应中熵变小于0,焓变大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.判断反应能否自发进行需要根据ΔH与ΔS综合考虑
参考答案:D
本题解析:试题分析:根据反应的化学方程式可知,有气体生成,熵变大于0,A不正确;由于熵变大于0,所以该反应仍然是自发的,B不正确;C不正确,因为判断反应能否自发进行需要根据ΔH与ΔS综合考虑,所以选项C不正确,D正确,答案选D。
考点;考查反应自发性的判断
点评:反应的自发性,既和焓变有关系,也和熵变有关系,需要综合分析,才能得出正确的结论,而不能把二者孤立开。根据△G=△H-T·△S可知,只要△G小于0,反应就是自发的,据此可以进行有关判断。
本题难度:简单
4、计算题 铬的化学丰富多采,实验结果常出人意料。将过量30% H2O2加入(NH4)2CrO4的氨水溶液, 热至50oC后冷至0oC,析出暗棕红色晶体A。元素分析报告:A含Cr 31.1%,N 25.1%,H 5.4%。在极性溶剂中A不导电。红外图谱证实A 有N-H键,且与游离氨分子键能相差不太大,还证实A 中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。
3-1 以上信息表明A 的化学式为:?;可能的结构式为:?。
3-2? A 中铬的氧化数为:?。
3-3 预期A 最特征的化学性质为:?。
3-4 生成晶体A的反应是氧化还原反应,方程式是:?。
参考答案:3-1? A 的化学式Cr(NH3)3 O4或CrN3H9O4(写成其他形式也可以)? (2分)
A 的可能结构式如下图:? (4分) 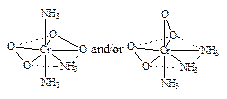
1式和/或2式均得满分,但无2个过氧键O—O者得零分。
(编者注:还可画出其他结构式,但本题强调的是结构中有2个过氧键,并不要求判断它们在结构中的正确位置。)
3-2? A 中铬的氧化数为 +4? (2分)
3-3 氧化还原性(或易分解或不稳定等类似表述均得满分)?(2分)
3-4 化学方程式:CrO42-+3NH3+3H2O2=Cr(NH3)3(O2)2+O2+2H2O+2OH– ?(2分)
本题解析:此题是利用已经形成的但一般教科书未涉及的知识编制成的探究式试题。如本文开头所述,属于谜底为新知识的谜语式试题。此题信息很多,为缕清信息相互关系,最形象的方法是制作一张破案式的线索图,下面只是一例(制作什么样的图并无模式可循,依应试者思维特征不同而异,图也不一定在纸上画出来,在脑中构建也一样可以——这要看应试者脑子清晰不清晰,右脑发达不发达而定):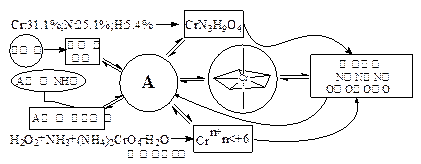
从这个“破案线索图”可以判断出“犯案人”A只能是含2个过氧团的铬(IV)配合物。因为过氧团可以从过氧化氢中转移过来,有来源(如果此题没有A的生成反应的信息,当然也可以假设配合物里存在H2N—NH2,同时有—OH的配体,但生成反应排除了这个“嫌疑犯”);同时也排除1个过氧团或者没有过氧团的可能,因为生成反应是氧化还原反应,在K2CrO4中铬的价态(或说氧化态)已经达到最高价,只能发生还原反应,铬的价态必低于+6,因此A是唯一的。
[评论] 此题重在形成知识的过程。当然,作为试题,并未给出实际科学研究获得的全部信息,例如红外图谱中肯定同时显示了A中有过氧键,却被命题人“制谜”时略去了,否则会降低解谜的智力测试水平。平心而论,此题的知识要求是较多的,但在中学课本里都已涉及,如:应试者至少需要有配合物(络合物)的基本概念(中学有Cu(NH3)42+、Ag(NH3)2+、Fe(CN)64–、Fe(SCN)63–等)、过氧化合物的知识(中学有H2O2)、铬的价态及作为氧化剂的知识(中学有重铬酸盐作氧化剂的例子)、氧化数的概念、配价键或者配位键的概念(中学有电子对的给予和接受的实 际例子)、电解质的概念、由元素组成求分子量的技能(此题氧原子数需用余量来求,这既符合实际科研信息,又增加了试题难度),等等。由于这些知识基础不超纲,不能说此题对已有知识基础要求太高,试题难是难在这样多的知识要综合在一起,由应试人得出一个从未见过的结构式(按说只有左边的结构图是正确的,但命题人并不这样要求,是符合应试者水平的判分标准,再次体现了竞赛判分的特点),因此此题的智力要求确实比较高,理解力、分析力、综合力、联想力、想象力、创造力都进行了考察。如果实测结果此题难度太高,可在今后命题时适当减少信息量,降低综合度,不要连这种命题思路一起泼走。
本题难度:一般
5、选择题 下列说法中错误的是
A.CO2、SO3都是极性分子
B.KF是离子化合物,HF为共价化合物
C.在NH4+和[Cu(NH3)4]2+中都存在配位键
D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构
参考答案:A
本题解析:A、CO2、SO3都是非极性分子,A不正确;B、KF含有离子键,是离子化合物,HF含有共价键,为共价化合物,B正确;C、在NH4+和[Cu(NH3)4]2+中都存在配位键,且都是氮原子通过孤对电子,C正确;D、对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,则PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构,D正确,答案选A。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《离子共存》.. | |