微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某学习小组对炭粉与氧化铁反应产物中气体的成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳(CO2)。
(2)设计方案:将一定量的氧化铁与炭粉的混合物在隔绝氧气的条件下完全反应(如下图),测定参加反应的碳元素与氧元素的质量比。

实验装置
(3)查阅资料:N2不与炭粉以及氧化铁发生反应,可用于隔绝氧气进行反应。
(4)实验操作:
①称取5.2 g氧化铁与炭粉的混合粉末,放入48.48 g的玻璃管中,按上图连接后必不可少的实验操作为___________________________________________________。
②加热前,先通一段时间纯净、干燥的氮气,其目的是_____________________________。
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊,该现象说明_____________________。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24克。
(5)数据处理:经计算,参加反应的碳元素质量为0.48克,氧元素质量为0.96克。
(6)得出结论:根据数据处理结果,反应生成的气体为CO和CO2,而且同条件下体积比为1∶1,原假设不成立,理由为__________________________________________________。
(7)该实验反应的化学方程式为_________________________________________________。
参考答案:(4)①检查装置气密性? ②排尽装置中的空气(或氧气)? ③有二氧化碳气体生成
(6)C、O质量比为0.48∶0.96=1∶2,与二氧化碳中C和O质量比3∶8不符
(7)2C+Fe2O3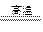 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
本题解析:根据题意,本实验为一定量实验,其原理是将一定量Fe2O3和C的混合物在用N2隔绝氧气的条件下完全反应,测参加反应的C元素和O元素的质量比,判断反应产物是否全是CO2。因此反应装置必须气密性好。
参加反应的C元素质量为0.48 g,物质的量为0.04 mol,O元素的质量为0.96 g,物质的量为0.06 mol,生成的碳氧化物中C、O物质的量之比为2∶3,则 ,即CO、CO2的物质的量比为1∶1,因此原假设不成立。该实验反应的化学方程式为2C+Fe2O3
,即CO、CO2的物质的量比为1∶1,因此原假设不成立。该实验反应的化学方程式为2C+Fe2O3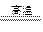 2Fe+CO↑+CO2↑。
2Fe+CO↑+CO2↑。
本题难度:简单
2、选择题 下列表述不正确的是(? )
A.常温下,SiO2性质较稳定,不与所有的酸发生反应
B.硅酸钠的水溶液俗称水玻璃,可作防火材料
C.硅是一种亲氧元素,在地壳中的含量仅次于氧
D.玻璃、陶瓷、水泥都属于硅酸盐产品
参考答案:A
本题解析:常温下,SiO2性质较稳定但是可以和HF酸反应,A错误。硅酸钠的水溶液俗称水玻璃,是一种粘胶,可作防火材料。自然界在元素含量为氧、硅、铝、铁,硅在地壳中的含量仅次于氧。
本题难度:简单
3、判断题 硅晶体结构类似于金刚石,低温下单质硅不活泼,与空气、H2O、酸均无作用,但可与强碱和强氧化剂在适当温度下作用,如硅能与卤素在加热或高温下生成四卤化硅;高价态硅的化合物可在高温下被碳、镁、氢等还原剂还原成单质硅;工业上也可用硅与焦炭在高温下制金刚砂(SiC)。某高纯硅炼制厂利用食盐、石英、水、焦炭为原料制取用作半导体材料的高纯硅。根据上述材料回答:
(1)假设根据每步反应建立一个生产车间,该高纯硅厂家需要几个车间
A.3个? B.4个? C.5个? D.6个
(2)生产原理中没有涉及到的反应是
A.置换反应? B.复分解反应
C.化合反应? D.电解反应
(3)该厂家不采用石英与焦炭直接制高纯硅的主要原因是
A.产量太低? B.产品中含SiC
C.产品中含有过量的硅石和焦炭? D.耗能太大
参考答案:(1)B?(2)B?(3)B
本题解析:主要牵扯的反应有:①电解食盐水制取氢气和氯气;②高温下石英与焦炭反应制取粗硅;③在加热条件下粗硅与氯气反应;④用氢气将生成的四氯化硅还原得高纯硅。由此可知答案。
本题难度:简单
4、填空题 钇(Y)是激光材料、超导材料和磁性材料中的重要元素,在激光诊断、激光治疗领域、超导发电机、超导磁悬浮列车、微波领域中有着重要作用。
(1)有一种铁、氧、钇三种元素组成的磁性材料,经测定该材料中钇、铁的原子个数之比为3∶5,氧的质量分数约为26.0%,则该材料的化学式为___________,钇、铁的化合价分别为___________。
(2)某钇矿石的主要成分是Be2YxFeSi2O10,该矿石与过量氢氧化钠共熔后,加水溶解,所得沉淀物中有Y(OH)3和Fe2O3(反应时Y的化合价不变,Fe由+2价转变为+3价)。试推算:此钇矿石的化学式中x=___________。若改用氧化物的形式表示其组成,则化学式为___________。
参考答案:(1)Y3Fe5O12? +3、+3
(2)2? 2BeO·Y2O3·FeO·2SiO2
本题解析:(1)设该物质化学式中钇、铁、氧的原子个数之比为3∶5∶n,则可列式为:
16n/(89×3+56×5+16n)×100%=26.0%
解得n=12,因为各原子的个数之比已为最简比,即其化学式为Y3Fe5O12。由化学式中各元素的化合价代数和为零,可推出钇、铁的化合价分别为+3、+3。
(2)根据化合价规则(化合物中各元素化合价的代数和为0)有:2×2+3x+2+2×4=2×10,解得x=2,即钇矿石的化学式为Be2Y2FeSi2O10。改写成氧化物的形式为2BeO·Y2O3·FeO·2SiO2。
本题难度:简单
5、选择题 生石灰中往往含有杂质CaCO3和SiO2,要检验是否存在这两种杂质,最好选用
A.水
B.盐酸
C.硫酸
D.烧碱溶液
参考答案:B
本题解析:CaCO3和SiO2都不溶于水,加入水会产生沉淀,但是生石灰与水反应生成微溶物氢氧化钙也会产生沉淀,无法检验A错误;若含有CaCO3和SiO2加入盐酸碳酸钙会与盐酸反应生成二氧化碳气体,产生气泡,B正确;硫酸与碳酸钙反应生成微溶五硫酸钙形成沉淀,但氧化钙也会与硫酸反应生成硫酸钙沉淀,C不能检验;烧碱是氢氧化钠,烧碱溶液会与二氧化硅反应生成硅酸钠,二氧化硅溶解,但是碳酸钙不反应依旧是沉淀,检验过程中现象不明显,D不能检验。
本题难度:一般