微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 请回答下列问题.
(1)水中存在平衡:H2O?H++OH-△H>0,欲使平衡右移,且溶液显酸性,可选的方法是______.(选填序号)
a.向水中加入NaHSO4固体?b.向水中加Na2CO3固体
c.加热至100℃d.向水中加入?(NH4)2SO4固体
(2)A、B、C、D?4种易溶于水的强电解质在水中可电离产生下列离子(各种离子不重复).
| 阳离子 | Ba2+、H+、Na+、Mg2+
阴离子
Cl-、SO42-、CO32-、OH-
|
①不进行任何实验即可判断,该4种化合中有2种是______、______(填化学式),该2种化合物的溶液混合时反应的离子方程式为______.
②为确定A、B、C、D的成分,某探究性学习小组进行下列实验,请完成实验结论:
| 实验序号 | 实验内容 | 实验结论
1
用pH试纸测得A、C两溶液呈碱性,B、D两溶液呈酸性
2
A溶液与B溶液混合时,有无色气泡产生
化合物A为______(填化学式)B溶液中肯定大量含有______(填离子符号);
3
C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解
化合物B为______,化合物D为______(填化学式).
参考答案:(1)水中存在平衡:H2O?H++OH-△H>0,欲使平衡右移,且溶液显酸性,说明是阳离子水解结合氢氧根离子生成弱电解质,溶液呈酸性;
a、向水中加入NaHSO4固体,抑制水的电离,平衡逆向进行,故a不符合;
b.向水中加Na2CO3固体,碳酸根离子水解促进水的电离,溶液呈碱性,故b不符合;
c.加热至100℃,促进水的电离,溶液是中性,故c不符合;
d.向水中加入 (NH4)2SO4固体,铵根离子水解促进水的电离,溶液呈酸性,故d符合;
故选d.
(2)①A、B、C、D 4种易溶于水的强电解质在水中可电离产生下列离子,依据离子共存分析判断,阴离子中碳酸根离子只能和钠离子组成物质碳酸钠;氢氧根离子只能和钡离子组成物质氢氧化钡;该2种化合物的溶液混合时反应的离子方程式:Ba2++CO32-=BaCO3↓,故答案为:Na2CO3;Ba(OH)2 ;Ba2++CO32-=BaCO3↓
②用pH试纸测得A、C两溶液呈碱性,所以为Na2CO3和Ba(OH)2 ;B、D两溶液呈酸性为MgCl2、H2SO4或MgSO4、HCl;
A溶液与B溶液混合时,有无色气泡产生,证明A为Na2CO3;B为酸含有H+;C为Ba(OH)2 ;
C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解,溶解的沉淀是氢氧化镁沉淀,不溶解的是硫酸钡,判断D中为MgSO4;B为HCl;
故答案为:Na2CO3 ;H+;HCl;MgSO4;
本题解析:
本题难度:一般
2、填空题 (12分)某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为 。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品,放入烧杯内
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是 。
②上述配制过程中,除使用烧杯、量筒外,必不可少的玻璃仪器还有
Ⅱ.标定FeSO4溶液的浓度
(1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.1000 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,据此可测得FeSO4溶液的物质的量浓度为______。
(2)滴定时选用____ (A.石蕊B.酚酞C.不用指示剂,填序号)为指示剂,选用的理由是 。
参考答案:Ⅰ(1)A→B→C→E→D(2)①抑制Fe3+、Fe2+水解 。②100 mL容量瓶、胶头滴管、玻璃棒 。
Ⅱ(1)0.5mol/L (2) C 可利用KMnO4溶液紫色不再褪去判断滴定终点.
本题解析:Ⅰ(1) FeSO4会发生水解,所以要先在水中加入一些硫酸来抑制水解,A放在最前,然后在称取药品,将药品溶解,加入铁粉防止 FeSO4被氧化,过滤出过量的铁粉,将滤液转移到容量瓶中,所以顺序为A→B→C→E→D。(2) ①FeSO4会发生水解,所以要先在水中加入一些硫酸来抑制水解。②配制一定物质的量浓度的溶液时一定要用到容量瓶,规格选用100 mL,溶解和转移液体是要用到玻璃棒,定容时还要用到胶头滴管。Ⅱ. (1)根据方程式:5 Fe2+ + MnO4- + 8H+ ="=5" Fe3+ + Mn2+ +4H2O 设Fe2+ 浓度为c,则 c(Fe2+) ×20.00 mL =5×0.1×20.00 mL,c(Fe2+) =0.5 mol·L-1。(2) KMnO4溶液是紫色溶液,可以根据溶液颜色变化来确定滴定终点,所以不需要指示剂。
考点:溶液的配制和氧化还原反应滴定。
本题难度:一般
3、选择题 常温时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为 ( )
A.A>B
B.A=10-4 B
C.B=10-4 A
D.A=B
|
参考答案:B
本题解析:酸和碱都抑制水的电离,能水解的盐促进水的电离,NaOH自身能电离出OH-,所以溶液中的H+是水电离出来的,因此水电离的OH-为10-9mol/L,CH3COONa自身不能电离出OH-,所以溶液中的OH-都是水电离出来的,因此水电离的OH-为10-5mol/L。所以A=10-4 B,答案选B。
考点:考查水电离的离子浓度的计算。
本题难度:一般
4、选择题 下列电离方程式中,正确的是( )
A.H2SO4=2H++SO4-2
B.NaOH=Na++O2-+H+
C.Na2CO3=2Na++CO32-
D.Ca(NO3)2=Ca2++(NO3)22-
参考答案:A、硫酸根离子的符号为:SO42-,正确的离子方程式为:H2SO4=2H++SO42-,故A错误;
B、氢氧根离子是一个整体进行电离的,正确的离子方程式为:NaOH=Na++OH-,故B错误;
C、该离子方程式离子书写正确,电荷守恒,故C正确;
D、物质电离后角标要转化成化学计量数,正确的离子方程式为:Ca(NO3)2=Ca2++2NO3-,故D错误;
故选:C;
本题解析:
本题难度:一般
5、选择题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液浓度和混合所得溶液的pH如下表所示
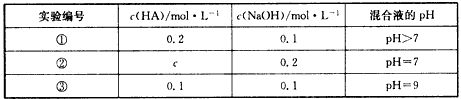
下列说法中,不正确的是
[? ]
A.由实验①可知,HA为弱酸
B.实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+)
C.实验②所得混合溶液:c(Na+)=c(A-)
D.实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9 mol/L
参考答案:D
本题解析:
本题难度:一般