微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 每个公民都应该有安全意识,近几年频繁发生的有关化学品泄露或爆炸事件一次又一次地给我们敲响了警钟。下列做法存在安全隐患的是(?)
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌?
②给试管中的液体加热时,应将试管倾斜,试管口斜向上,与桌面成45°角,直接集中在药品处加热?
③夜间厨房发生煤气泄漏,应立即开灯检查煤气泄漏的原因,并打开所有门窗?
④废旧电池应回收处理?
⑤不慎将浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗?
⑥氢气还原氧化铜实验先加热再通氢气
A.全部
B.①②③⑤⑥
C.①③⑤⑥
D.③⑤⑥
参考答案:B
本题解析:只有④正确;①浓硫酸的稀释:应将浓硫酸沿烧杯内壁缓缓加入水中,并用玻璃棒不断搅拌;②应对试管均匀受热,再集中在药品处加热;③不能开灯,因煤气泄漏遇明火易爆炸;⑤应先用干抹布擦掉浓硫酸,然后用大量水冲洗,最后再用弱碱性的碳酸氢钠溶液涂抹来中和;⑥氢气还原氧化铜实验先通氢气再加热;
本题难度:简单
2、实验题 某化学小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下图所示:

(1)步骤①中氧化铜与盐酸反应的离子方程式是______________________________。
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是__________。
(3)已知:
?
| 氢氧化物开始沉淀时的pH
| 氢氧化物沉淀完全时的pH
|
Fe
| 1.9
| 3.2
|
Fe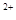
| 7.0
| 9.0
|
Cu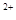
| 4.7
| 6.7
|
提供的试剂:a. NaOH? b. H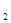 O O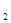 ? c. Na ? c. Na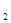 CO CO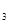 ? d. CuO ? d. CuO
|
参照表中给出的数据和试剂,请回答:
步骤②的目的是_______________________,反应的离子方程式是_________________。
步骤③中调节溶液pH的范围是__________,试剂Y是__________(填字母)。
(4)在步骤④中所进行的一系列操作是______________________________。
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl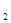 ·2H
·2H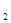 O,其作用是____________________________________。
O,其作用是____________________________________。
参考答案:(1)CuO+2H+=Cu2++H2O?(2)普通漏斗、玻璃棒、烧杯
(3)将Fe2+氧化成Fe3+;2Fe2++H2O2+2H+="2" Fe3++2H2O;3.2≤pH<4.7;d
(4)蒸发浓缩,冷却结晶,过滤,洗涤
(5)干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2·2H2O受热产生的水汽
本题解析:(1)氧化铜是碱性氧化物,和盐酸反应的离子方程式为CuO+2H+=Cu2++H2O。
(2)过滤操作中除了需要铁架台(带铁圈)外,还需要普通漏斗、玻璃棒、烧杯。
(3)由于溶液中含有亚铁离子,而亚铁离子的沉淀pH大于铜离子的,所以应该把亚铁离子转化为铁离子而产生氢氧化铁沉淀,从而除去杂质。反应的离子方程式为2Fe2++H2O2+2H+="2" Fe3++2H2O。要沉淀铁离子而保留铜离子,则根据pH可知,应该是3.2至4.7之间。由于调节pH是不能引入杂质的,所以答案选d。
(4)要得到氯化铜晶体,则应该是蒸发浓缩,冷却结晶,然后过滤、洗涤干燥即可。
(5)氯化铜是强酸弱碱盐,水解生成氢氧化铜和氯化氢。所以在加热过程中,应该在氯化物的气流中进行以防止CuCl2发生水解同时还能带走CuCl2·2H2O受热产生的水汽。
点评:本题综合性较强,重点考查了学生的实验基本操作。
本题难度:一般
3、选择题 关于下列各装置图的叙述中,正确的是
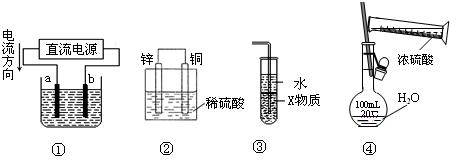
A.若采用装置①精炼铜,则a极为纯铜, b极为粗铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸
D.装置④可用于实验室配置一定物质的量浓度的稀硫酸
参考答案:C
本题解析:略
本题难度:一般
4、选择题 在实验室中,对下列事故或药品的处理正确的是(? )
A. 漂白粉可长期放置在烧杯中
漂白粉可长期放置在烧杯中
B.金属钠燃烧时,不能用泡沫灭火 器灭火,应该用沙
器灭火,应该用沙 子灭火
子灭火
C.氯水可以用无色透明的试剂瓶装保存
D.有大量的氯气泄漏时,用氢氧化钠 溶液浸湿软布蒙面,并迅
溶液浸湿软布蒙面,并迅 速离开现场
速离开现场
参考答案:B
本题解析:略
本题难度:简单
5、实验题 过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母):?。
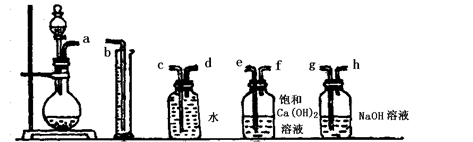
①?②?③?④?⑤
(2)装置④的作用是?。
(3)如果实验时,称取w g样品和过量盐酸反应后,测得氧气的体积(标准状况)为V mL,则此样品的纯度为?。
参考答案:(9分)
(1) a→g,h→e,f→d,c→b?
(2)检验CO2是否完全被吸收?
(3)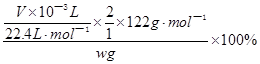
本题解析:(1)过碳酸钠和碳酸钠均能与足量的盐酸反应,放出含有CO2和O2的气体,CO2对O2体积测量有干扰,因此利用排水量气法收集O2之前,需要除去CO2并确认CO2已经被完全除尽;图中几个装置的作用分别是制气、量液或O2的体积、排水集O2、确认是否含有CO2、除去CO2,除去并检验CO2时气体应该长进短出,排水集O2时应短进长出,因此这套装置的连接顺序为a→g,h→e,f→d,c→b;(2)、见(1);(3)、先由n=V/Vm求 n(O2),再由反应式2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O中过碳酸钠与氧气的化学计量数之比等于物质的量之比求 n(Na2CO4),然后再由m=n?M求m(Na2CO4),最后由过碳酸钠的质量和样品的质量求纯度。
本题难度:一般