微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有一块Fe、Al合金,将其全部溶于盐酸中,并通人足量的Cl2,再加入过量的NaOH溶液,过滤,将沉淀充分灼烧,得到的固体粉末跟原合金质量相等,求合金中铝的质量分数。
参考答案:30%
本题解析:各步反应原理如下图所示:
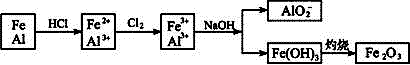
由已知,所得固体粉末的质量与原合金质量相等,根据Fe元素的质量守恒,可得合金中Fe的质量等于Fe2O3中Fe的质量,则合金中Al的质量应等于Fe2O3中O的质量,即Al的质量分数为
本题难度:简单
2、选择题 铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为(?)
A.22.2%
B.75.7%
C.30.0%
D.80.6%
参考答案:C
本题解析:根据题意得到的固体为Fe2O3,该物质与原混合物质量相等,所以Fe2O3中O元素的质量与混合物中Al元素的质量相等,所以合金中铝的质量分数为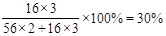 。答案选C。
。答案选C。
点评:本题主要利用质量守恒的方法进行计算,考查学生的分析能力。
本题难度:一般
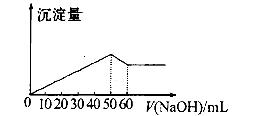
3、选择题 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液生成沉淀的量与滴入NaOH溶液的体积关系如图所示则原混合溶液中Al2(S04)3与MgSO4的物质的量浓度之比为
A.6:1
B.3:1
C.2:1
D.1:2
参考答案:D
本题解析:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积为50mL-30mL=20mL,则n(Mg2+):n(Al3+)=1/2×20mL:1/3×30mL=1:1,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为1/2:1=1:2,故选D.
本题难度:一般
4、选择题 化学与数学有密切的联系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的良好效果。下列用数轴表示的化学知识中不正确的是
[? ]
A.铁与稀硝酸反应后溶液中铁元素的存在形式 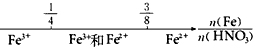
B.AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 
C.分散系的分类 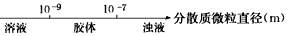
D.CO2通入澄清石灰水中反应的产物 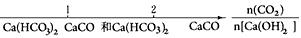
参考答案:D
本题解析:
本题难度:一般
5、选择题 将足量的铝粉分别加入下列100ml溶液中,充分反应后,放出氢气最多的是? ( )
A.3mol·L-1 HCl
B.4mol·L-1 HNO3
C.8mol·L-1NaOH
D.5mol·L-1 H2SO4
参考答案:C
本题解析:A、最多产生氢气0.15mol;C、产生1.2mol,D产生0.5mol;B没有氢气产生。
本题难度:一般