微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 国际纯粹与应用化学联合会(IUPAC)将117号元素暂时命名为Uus,以下关于Uus的叙述正确的是
A.是稀有气体? B.有放射性? C.是第六周期元素? D.质量数为117
参考答案:B
本题解析:117号元素是第七周期元素,都是放射性元素,B正确。
本题难度:一般
2、选择题 铝元素在周期表中的位置是?(?)
A.ⅠA族
B.ⅡA族
C.ⅢA族
D.ⅣA族
参考答案:C
本题解析:略
本题难度:简单
3、填空题 (24分)
X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X、W在周期表中的相对位置如下表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素。

(1)元素Q在周期表中位于第_____族,Z的离子结构示意图为_____。
(2)Z、W、Q的原子半径由大到小的顺序为?。(用元素符号表示其原子)。
(3)X和氢组成的化合物分子中有6个原子,其结构简式为______,写出该物质与水加成的化学方程式?。
(4)Y的最简单气态氢化物甲的水溶液显碱性
①用电离方程式表示氢化物甲的水溶液中的显碱性的原因?,
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____?__。该反应的氧化剂是?当有1mol甲参加反应时,电子转移??mol。
③Y的最简单气态氢化物甲和Q的氢化物乙反应生成正盐的电子式??,?
该化合物中所含化学键类型是??,该化合物属于??晶体。
参考答案:
(1)ⅥA(2分)?、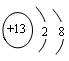 ? (2分)?(2)Al>P>Cl? (2分)
? (2分)?(2)Al>P>Cl? (2分)
(3)CH2==CH2?(2分)
CH2="=CH2" + H2O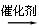 CH3CH2OH (2分)
CH3CH2OH (2分)
(4)① ② 2NH3 + 3H2O2 ="==" N2?+6H2O (2分)?H2O2 ?(2分)3mol?(2分)
② 2NH3 + 3H2O2 ="==" N2?+6H2O (2分)?H2O2 ?(2分)3mol?(2分)
③(NH4)S电子式略?(2分)?离子键和共价键?(2分)离子晶体?(2分)
本题解析:略
本题难度:简单
4、选择题 已知下列元素的原子半径:
元素
| N
| S
| O
| Si
|
原子半径/10?10 m
| 0.75
| 1.02
| 0.74
| 1.17
|
根据以上数据,磷元素的原子半径可能是(? )
A.0.80×10?10 m?B.1.10×10?10 m
C.1.20×10?10 m?D.0.70×10?10 m
参考答案:B
本题解析:因为同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大。所以磷原子的半径大于硫原子和氮原子的,但小于硅原子的,所以选项B正确。答案选B。
本题难度:一般
5、填空题 (8分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置?;
(2)E元素形成的最高价氧化物对应的水化物的化学式为?;
(3)元素C、D、E形成的离子半径大小关系是?>?>?(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程?。
C、D还可形成化合物D2C2,D2C2含有的化学键是?。
(5)由A、B、C三种元素形成的离子化合物的化学式为?。
参考答案:(1)第二周期第VA族(1分,都回答正确才给分)
(2)H2SO4?(1分)?(3)S2->O2->Na+(1分)
(4)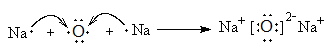 (2分) (有错不给分)
(2分) (有错不给分)
离子键、非极性共价键(或离子键、共价键)(2分,全对才给分)
(5)NH4NO3 ?(1分)
本题解析:根据元素的结构及性质可知,A、B、C、D、E分别是H、N、O、Na、S。
(1)氮元素位于第二周期第VA族。
(2)S是第ⅥA元素,最高价是+6价,所以形成的最高价氧化物对应的水化物的化学式为H2SO4。
(3)核外电子排布相同的微粒,其离子半径随原子序数的增大而减小,同主族自上而下,离子半径也是逐渐增大的,所以元素C、D、E形成的离子半径大小关系是S2->O2->Na+。
(4)氧化钠是含有离子键的离子化合物,其形成构成表示为
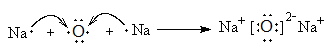 。过氧化钠是含有离子键和非极性键的离子化合物。
。过氧化钠是含有离子键和非极性键的离子化合物。
(5)H、N、O三种元素形成的离子化合物的化学式为NH4NO3。
本题难度:简单