微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)0.1mol/L的HCN溶液与0.1mol/L的NaCN溶液等体积混合,混合后溶液的pH>7,说明:HCN的电离程度?CN-的水解程度;离子浓度大小顺序为?电荷守恒__________?;物料守恒_____?
参考答案:小于?c(Na+)>c(CN-)>c(OH-)>c(H+)
c(Na+)+c(H+)=c(CN-)+c(OH-)
c(CN-)+ c(HCN)=2 c(Na+)(或者c(CN-)+ c(HCN)="0.1)"
本题解析:混合后溶液的pH>7,说明此溶液显碱性,进一步说明CN-的水解强于HCN的电离。溶液中离子的浓度大小为c(Na+)>c(CN-)>c(OH-)>c(H+);电荷守恒:c(Na+)+c(H+)=c(CN-)+c(OH-),物料守恒:c(CN-)+ c(HCN)=0.1mol/L。
点评:本题考查了电解质溶液的相关知识,解题过程中应掌握以下规律:①对于溶液酸碱性的判断,可以从弱离子的电离与水解入手,比较离子浓度的大小。②对于溶液中离子浓度大小的比较,在考虑弱离子的电离水解后,应注意任何溶液中均存在着水的电离。
本题难度:一般
2、计算题 已知t℃时,纯水中[H+]=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积Ksp[Mg(OH)2]=3.2×10-11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为多少?
参考答案:10
本题解析::Mg(OH)2(s)?Mg2+(aq)+2(OH)-(aq) ?Ksp[Mg(OH)2]=3.2×10-11mol3·L-3
设[Mg2+]为x则:[OH-]为2x
Ksp[Mg(OH)2] = [Mg2+]·[OH-]2
=x·(2x)2=3.2×10-11mol3·L-3
解得:x=2×10-4mol·L-1
所以[OH-]=2x=4×10-4 mol·L-1
由于纯水中[OH-]=[H+]=2×10-7 mol·L-1
所以Kw=[H+]·[OH-]=4×10-14 mol2·L-2
在饱和的Mg(OH)2溶液中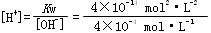 =1×10-10 mol·L-1
=1×10-10 mol·L-1
pH=-lg[H+]=-lg(1×10-10)
=10
本题难度:简单
3、选择题 pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是(?)
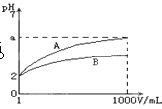
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a=5时,A是弱酸,B是强酸
D.若A、B都是弱酸,则5>a>2
参考答案:D
本题解析:等pH的酸加水稀释,酸性强的pH变化大。起始时pH相等,但两种酸的强弱未知,所以物质的量浓度不一定相等,A错误;稀释后A酸溶液pH大,c(H+)小,酸性弱,B错误;若a=5,则A是强酸、B是弱酸,C错误;若A、B均是弱酸,则2<a<5,D正确。
点评:同pH的弱酸与强酸加水稀释相同的倍数,强酸pH变化大。
本题难度:一般
4、选择题 下列溶液中微粒浓度关系一定正确的是
A 均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者
B? 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
C? 25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者
D. 25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7
参考答案:A
本题解析:A中HSO4-显酸性,对NH4+水解起抑制作用,NH4HSO4中大于NH4Cl中NH4+浓度,A正确。Kw与温度有关,升高温度,Kw增大,B错;对于强碱来说,每稀释10倍,pH下降1个单位,由于弱碱部分电离,加水促进其电离,所以OH-的物质的量浓度当稀释相同的倍数时,弱碱碱性要比强碱要强,C错;从已知条件看部分电离的OH-与完全出的H+“刚好”中和,但氨水水的物质的量浓度要比盐酸在大,反后氨水过量,中和后显碱性,D错;答案选A。
本题难度:一般
5、选择题 在298K、101kPa时,已知:H2O(g) ===? H2O(l);△H1
C2H5OH(g) ="==" C2H5OH(l);△H2?C2H5OH(g)+3O2(g) ="==" 2CO2(g)+3H2O(g);△H3
则酒精的燃烧热△H =
A.△H1+△H2+2△H3
B.△H1—△H2+△H3
C.3△H1+△H2+△H3
D.3△H1—△H2+△H3
参考答案:D
本题解析:燃烧热是指:25℃、101kP下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量称为该物质的燃烧热。
注:C→CO2(g);H→H2O(l);S→SO2(g)
结合盖斯定律可得酒精的燃烧热为:3△H1—△H2+△H3
本题难度:一般