| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《原电池原理》答题技巧(2017年最新版)(六)
参考答案: 本题解析: 本题难度:一般 2、填空题 (16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。 |
参考答案:Ⅰ.(1)B (2分)
(2)N2O4(g)  2NO2(g) △H="+56.9kJ/mol" (2分)
2NO2(g) △H="+56.9kJ/mol" (2分)
(3)0.9 (2分) (4)① > (2分) ② (2分)
(2分)
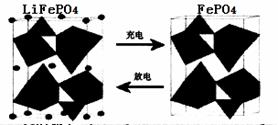
Ⅱ.正(2分) FePO4+e-+Li+=LiFePO4 (2分) 0.168 (2分)
本题解析:Ⅰ.(1)A、反应前后气体的化学计量数之和不等,故容器总压强不随时间改变可作为判断是否达到化学平衡状态的依据,正确;B、总质量不变,体积也不变,故混合气体的密度不随时间变化而改变不能作为判断是否达到化学平衡状态的依据,错误;C、NO2为红棕色气体,N2O4为无色气体,故混合气体的颜色不随时间变化而改变可作为判断是否达到化学平衡状态的依据,正确;D、总质量不变,总物质的量在变,故反应混合气平均分子量不再改变可作为判断是否达到化学平衡状态的依据,正确。
(2)由图1可知,反应物为N2O4,生成物为NO2,反应进行到10min时,N2O4的物质的量变化为0.2mol/L×1L=0.2mol,共吸收热量11.38kJ,故反应1molN2O4共吸收热量11.38×5=56.9kJ,故该反应热化学 方程式为:N2O4(g)?2NO2(g),△H=+56.9kJ?mol?1。
(3)k= c2(NO2)/ c(N2O4) =0.62÷0.4=0.9。
(4)①恒容,充入一定量NO2,相当于增大压强,平衡逆向移动,新平衡后混合气体中NO2的体积分数减小,故W1>W2。
②30min时,c(NO2)=0.9mol/L,k=0.92 ÷c(N2O4) =0.9,c(N2O4)=0.9mol/L,20min-30min,N2O4的浓度增加了0.9-0.4=0.5mol/L,故NO2的浓度减少了1mol/L,则20min时,c(NO2)=1+0.9=1.9mol/L,可画出20 min后各物质的浓度随时间变化的曲线。
Ⅱ.(1)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4。
(2)计算得到,电解含有0.01mol CuSO4和0.01molNaCl的混合溶液100mL,电路中转移了0.02mol e-,
阳极:2Cl- -2e- =Cl2↑,
0.01mol 0.01mol 0.005mol
4OH--4e-=2H2O+O2↑,
0.01mol 0.01mol 0.0025mol所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L。
考点:本题考查图像的分析及绘画、化学平衡状态、化学平衡常数、热化学方程式、原电池原理及应用。
本题难度:困难
3、选择题 关于下列各图的叙述,正确的是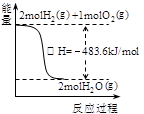 ?
? ?
? ?
?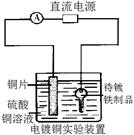
甲?乙?丙?丁
A.甲表示H2与O2发生反应过程中的能量变化,则H2的烧热为483.6kJ·mol-1
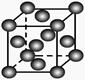
B.乙表示Cu形成金属晶体时的堆积方式
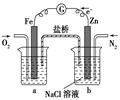
C.丙装置中烧杯a中的溶液pH降低
D.丁装置中待镀铁制品应与电源正极相连
参考答案:B
本题解析:H2的燃烧热为241.8kJ·mol-1,A选项不正确;铜是面心最密堆积,B选项正确;a中pH值增大,C选项不正确;待镀铁制品应与电源负极相连,D选项不正确。
本题难度:一般
4、选择题 X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为(?)
A.X>Z>Y>M
B.X>Y>Z>M
C.M>Z>X>Y
D.X>Z>M>Y
参考答案:A
本题解析:金属X和Z用导线连接放入稀硫酸中时,X溶解,说明X是负极,即金属性是X强于Z;电解Y2+和Z2+共存的溶液时,Y先析出,说明Y的金属性弱于Z的;金属性越强,相应阳离子的氧化性越弱,所以根据M2+的氧化性强于Y2+可知,金属性是Y强于M,综上所述,金属性强弱顺序是X>Z >Y>M,答案选A。
点评:比较元素金属性强弱的一般依据是:1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强;2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强;3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强;4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属;5.依据金属活动性顺序表(极少数例外);6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强;7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性;8.依据电解池中阳离子的放电(得电子,氧化性)顺序。优先放电的阳离子,其元素的金属性弱。
本题难度:一般
5、填空题 ?有人将铂丝插入KOH溶液中做电极,又在两极片上分别通入甲烷和氧气,设计一种燃料电池,则通入甲烷的铂丝为______极,发生的电极反应为______.该电池放电反应的化学方程式为______.电池工作时,溶液的pH(填“变小”“不变”“变大”)______.
参考答案:负? CH4+10OH--8e-=CO32-+7H2O? CH4+2O2+2KOH=K2CO3+3H2O?变小
本题解析:因为该电池为燃料电池,依据的化学原理是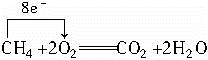 ?
?
在此反应中,CH4失去电子,因此通入CH4的铂丝为负极。CH4在负极失电子转变成CO2,但因在碱性条件下CO2将转化成CO32-,所以负极反应为:
CH4+10OH--8e-= CO32-+7H2O
正极反应为:2O2+8e-+4H2O=8OH-
该电池放电反应的化学方程式为:
CH4+2O2+2KOH=K2CO3+3H2O
由此可知反应过程中c(OH-)不断减小,c(H+)则不断增大,pH将变小。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《未知》试题.. | |