微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学要对某溶液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
(1)
实验目的
| 操作
| 实验现象
| 结论
|
1.检验Cl—
| 取少许滤液于试管中,?
?
| ?
?
| 含有Cl—
|
2.检验NH4+
| 取少许滤液于试管中,?
?
| ?
?
| 含有NH4+
|
3.检验Zn2+
| 取少许滤液于试管中,加入稀氨水
| 先产生白色沉淀,继续加入氨水,沉淀又溶解
| 含有Zn2+
|
(2)根据以上的实验报告,关于滤液的成分,他的结论是:滤液中含有氯化铵和氯化锌
若想从滤液中得到溶质固体,还应进行的操作是加热蒸发(加热浓缩),???, 过滤。
若要将所得的溶质固体中的物质加以分离,可用?法。
参考答案:
实验目的
操作
实验现象
结论
1、检验Cl—
取少许滤液于试管中, 加入硝酸酸化的硝酸银溶液?
?有白色沉淀产生?
含有Cl—
2、检验NH4+
取少许滤液于试管中,?加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近?
?石蕊试纸变蓝色?
含有NH4+
(5)。冷却结晶?加热
本题解析:略
本题难度:一般
2、填空题 高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。下图是实验室制备的操作流程:
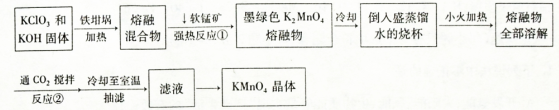
上述反应②的化学方程式: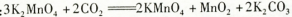
已知:
(1)加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚的理由是_______;
反应①的化学方程式为______。
(2)从滤液中得到KMnO4晶体的实验操作依次是________(选填字母代号,下同)。
A.蒸馏? B.蒸发 C.灼烧? D.抽滤? E.冷却结晶
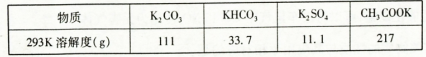
(3)制备过程中需要用到纯净的CO2气体。制取纯CO2净最好选择下列试剂中_________。
A.石灰石? B.浓盐酸 C.稀疏酸 D.纯碱
(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。原因是______?。
(5)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸?B.浓盐酸?C.稀硫酸
参考答案:(1)高温下强碱要腐蚀坩埚(瓷坩埚的主要成分是硅酸盐,含有二氧化硅,要与碱反应。)3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O(2)B E D (3)C D(4)KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5)A(因为盐酸有还原性;醋酸钾的溶解度比硫酸钾大很多,蒸发浓缩时基本上都会留在母液里)
3K2MnO4+KCl+3H2O(2)B E D (3)C D(4)KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5)A(因为盐酸有还原性;醋酸钾的溶解度比硫酸钾大很多,蒸发浓缩时基本上都会留在母液里)
本题解析:(1) 加热软锰矿、KClO3和KOH固体混合物时,由于KOH会与瓷坩埚中的SiO2发生反应:2KOH+SiO2 K2SiO3+H2O腐蚀坩埚,而不与Fe发生反应,所以要用铁坩埚。根据题意可知反应①的化学方程式为3MnO2+KClO3+6KOH
K2SiO3+H2O腐蚀坩埚,而不与Fe发生反应,所以要用铁坩埚。根据题意可知反应①的化学方程式为3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O 。 (2)从滤液中得到KMnO4晶体的实验操作依次是蒸发浓缩、冷却结晶、抽滤。因此选项为B、E、D。(3)制备过程中需要用到纯净的CO2气体,酸应该用不挥发性的酸——H2SO4,但是H2SO4与CaCO3发生反应产生CaSO4微溶于水,覆盖在CaCO3的表面,是反应不能再进行。所以盐应该用Na2CO3.选项为C、D。(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。原因是KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5) 若把实验中通CO2改为加其他的酸,因为有挥发性,不能选用,K2SO4的溶解度比CH3COOK小的多,因此综合考虑应该选择醋酸得到的产品纯度更高。故选项为A。
3K2MnO4+KCl+3H2O 。 (2)从滤液中得到KMnO4晶体的实验操作依次是蒸发浓缩、冷却结晶、抽滤。因此选项为B、E、D。(3)制备过程中需要用到纯净的CO2气体,酸应该用不挥发性的酸——H2SO4,但是H2SO4与CaCO3发生反应产生CaSO4微溶于水,覆盖在CaCO3的表面,是反应不能再进行。所以盐应该用Na2CO3.选项为C、D。(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。原因是KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5) 若把实验中通CO2改为加其他的酸,因为有挥发性,不能选用,K2SO4的溶解度比CH3COOK小的多,因此综合考虑应该选择醋酸得到的产品纯度更高。故选项为A。
本题难度:一般
3、填空题 苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原
理:
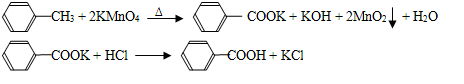
实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
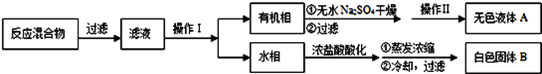
已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ?,需要用到的主要玻璃仪器为 ??;操作Ⅱ为 ?。
(2)无色液体A是?,定性检验A的试剂是 ?,现象是?。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。
序号
| 实验方案
| 实验现象
| 结论
|
①
| 将白色固体B加入水中,
加热溶解,??
| 得到白色晶体和无色溶液
| ?
|
②
| 取少量滤液于试管中,
?
| 生成白色沉淀
| 滤液含Cl-
|
③
| 干燥白色晶体,?
| ??
| 白色晶体是苯甲酸
|
?
(4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为?,计算结果为 ???。(保留两位有效数字)。
参考答案:(1)分液(1分),分液漏斗、烧杯等(1分);蒸馏(1分)
(2)甲苯(1分);酸性KMnO4溶液(1分),溶液褪色(1分)(3)
序号
实验方案
实验现象
结论
①
将白色固体B加入水中加热,溶解,冷却结晶、过滤 (2分)
得到白色晶体和无色溶液
?
②
取少量滤液于试管中,滴入2-3滴硝酸酸化的AgNO3溶液(2分)
生成白色沉淀
滤液含有Cl-
③
干燥白色晶体,加热使其融化,测其熔点(2分)
熔点为122.4℃(2分)
白色晶体是苯甲酸
?
(4)(2.40×10-3×122×4)/1.22(2分);96%(2分)
本题解析:(1)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到,分液操作的主要玻璃仪器是分液漏斗、烧杯等;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体;
(2)依据流程和推断可知,无色液体A为甲苯,检验试剂可以用酸性高锰酸钾溶液,甲苯被氧化为苯甲酸,高锰酸钾溶液紫色褪去;
(3)通过测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与KCl的混合物,氯化钾可以用硝酸酸化的硝酸银溶液检验氯离子的存在;利用苯甲酸的溶解度特征在25℃和95℃时溶解度分别为0.3g和6.9g;利用不同温度下的溶解度,分离混合物,得到晶体后通过测定熔点判断是否为苯甲酸;
(4)称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,苯甲酸是一元弱酸和氢氧化钾1:1反应,所以物质的量相同,则样品中苯甲酸质量分数=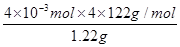 ×100%=96%。
×100%=96%。
本题难度:一般
4、选择题 实验室进行Na2SO4溶液蒸发时,一般有下列操作过程,其正确的操作顺序为:①固定铁圈位置?②停止加热,余热蒸干?③放置酒精灯?④放蒸发皿?⑤加热搅拌( )
A.①③④⑤②
B.③①④⑤②
C.①④③⑤②
D.③④①⑤②
参考答案:B
本题解析:
本题难度:简单
5、选择题 要除去CO2气体中所含的少量HCl气体,最好的方法是将混合气通过( )
A.饱和NaHCO 3溶液
B.Na2CO3溶液
C.饱和石灰水
D.氨水
参考答案:A
本题解析:A、NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,在除去氯化氢的同时增加了二氧化碳的量,故A正确;
B、Na2CO3溶液能够与二氧化碳反应,把二氧化碳也除去了,故B错误;
C、饱和的石灰水会吸收二氧化碳和氯化氢,把二氧化碳也除去了,故C错误;
D、氨水会吸收二氧化碳和氯化氢,把二氧化碳也除去了,故D错误.
故选A。
点评:进行物质除杂时,可以根据物质的性质,采用物理或化学的方法除去,要求所选的除杂试剂只与杂质反应,不能与原有物质反应,且反应后不能生成新的杂质。
本题难度:简单