微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
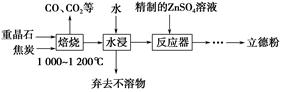
(1)焙烧时,焦炭需过量,其目的是:①____________________________;②____________________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO4(s) BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
反应器中发生反应的化学方程式为____________________________________。
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,需先后加入H2O2溶液和碳酸锌精制,加入H2O2溶液时发生反应的离子方程式为
________________________________,加入碳酸锌的目的是将溶液中的Fe3+转化为红褐色沉淀,写出该反应的化学方程式:__________________________________________。
参考答案:(1)①焦炭燃烧放热,提供反应所需温度
②提高重晶石的利用率
(2)K=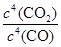
(3)BaS+ZnSO4=BaSO4↓+ZnS↓
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
Fe2(SO4)3+3ZnCO3+3H2O=3ZnSO4+2Fe(OH)3+3CO2↑
本题解析:(1)重晶石与焦炭反应需要高温,而焦炭燃烧可放出热量达到反应所需的高温,同时焦炭过量,必然使更多的重晶石参与反应,从而提高了重晶石的利用率。(3)由流程图可知,反应物为BaS与ZnSO4,可知它们发生复分解反应。(4)工业氧化锌用硫酸溶解时,溶液中存在Fe2+,而H2O2有强氧化性,可将其氧化为Fe3+;Fe3+在溶液中发生水解:Fe3++3H2O Fe(OH)3+3H+,加入ZnCO3与H+反应,使水解平衡向右移动,得到Fe(OH)3沉淀。
Fe(OH)3+3H+,加入ZnCO3与H+反应,使水解平衡向右移动,得到Fe(OH)3沉淀。
本题难度:一般
2、实验题 阿司匹林(乙酰水杨酸,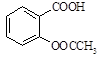 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
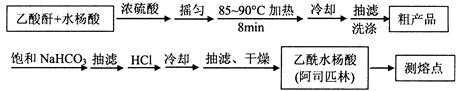
主要试剂和产品的物理常数
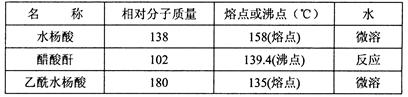
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,最合适的加热方式是?。
②抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是?。
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是?。
另一种改进的提纯方法,称为重结晶提纯法。方法如下:
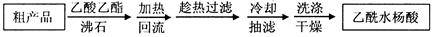
(3)改进的提纯方法中加热回流的装置如图所示,
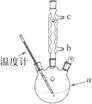
①使用温度计的目的是?。冷凝水的流进方向是?。(填“b”或“c”)。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因?。
(4)检验产品中是否含有水杨酸的化学方法是?。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.2 g,则所得乙酰水杨酸的产率为?。
参考答案:
(1)① 水浴加热
② 关小水龙头,向布氏漏斗中加蒸溜水至浸没沉淀物,待洗液完全滤出,洗涤2-3次。
(2)使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离
(3)① 控制反应温度,防止乙酰水杨酸受热分解;? b
② 水杨酸等有机杂质易溶于乙酸乙酯,冷却结晶时溶解在乙酸乙酯中很少结晶出来
(4)取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若溶液呈紫色则含水杨酸
(5)84.6%
本题解析:(1)①乙酰水杨酸受热易分解,分解温度为128~135℃,所以合成阿斯匹林时,最合适的加热方式是水浴加热。②水杨酸微溶解于水,温度越高,溶解度越大。所以为了要得到纯净的阿斯匹林抽滤所得粗产品要用少量冰水洗涤。洗涤的具体操作是关小水龙头,向布氏漏斗中加蒸溜水至浸没沉淀物,待洗液完全滤出,洗涤2-3次。(2)由于酸性乙酰水杨酸>H2CO3,所以加饱和NaHCO3溶液可以与乙酰水杨酸发生反应得到容易溶解于水的乙酰水杨酸钠,便于同步溶性的杂质分离。(3)①使用温度计的目的是控制反应温度,防止乙酰水杨酸受热分解。为了使冷凝效果提高,要使冷却水充满整个冷凝管。所以冷凝水的流进方向是b. ②重结晶提纯法所得产品的有机杂质要比原方案少是因为水杨酸等有机杂质易溶于乙酸乙酯,冷却结晶时溶解在乙酸乙酯中很少结晶出来。(4)检验水杨酸(邻羟基苯甲酸)的方法是看是否含有酚羟基。即:取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若溶液呈紫色则含水杨酸,否则就不含有水杨酸。(5)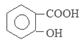 的相对分子质量为138,n(C7H6O3)=" 2.0" g÷138g/mol=0.0144mol;n(醋酸酐)=" (5.0" mL×1.08 g/cm3)÷102g/mol=0.0529mol.由于醋酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算。理论上得到乙酰水杨酸的质量为0.0144mol×180g/mol=2.6g.所以乙酰水杨酸的产率为(2.2g÷2.6g)×100%= 84.6%.
的相对分子质量为138,n(C7H6O3)=" 2.0" g÷138g/mol=0.0144mol;n(醋酸酐)=" (5.0" mL×1.08 g/cm3)÷102g/mol=0.0529mol.由于醋酸酐的物质的量大于水杨酸,所以得到的乙酰水杨酸应该按照水杨酸来计算。理论上得到乙酰水杨酸的质量为0.0144mol×180g/mol=2.6g.所以乙酰水杨酸的产率为(2.2g÷2.6g)×100%= 84.6%.
本题难度:一般
3、选择题 用括号内试剂除去下列各物质中少量杂质,错误的是
A.苯中己烯(溴水)
B.乙酸乙酯中乙酸(饱和Na2CO3溶液)
C.甲烷中乙烯(溴水)
D.苯中苯酚(NaOH溶液)
参考答案:A
本题解析:
答案:A
A.苯中己烯用溴水与己烯加成后生成的产物仍然溶解在苯中,应用酸性KMnO4氧化,再用NaOH溶液洗涤,分液。B正确,乙酸乙酯在饱和Na2CO3溶液中溶解度小,乙酸与Na2CO3反应生成CH3COONa; C.甲烷中乙烯与溴水发生加成反应,生成的二溴乙烷为液态;? D.苯中苯酚与NaOH溶液反应生成苯酚钠溶解在水中。
本题难度:一般
4、选择题 海水资源的利用包括海水的淡化,以下方法中,不能淡化海水的是
A.蒸馏法
B.过滤法
C.电渗析法
D.离子交换法
参考答案:B
本题解析:过滤法只能除去不溶于水的固体物质。所以B选项是错误的
本题难度:简单
5、选择题 下列属于分离、提纯液态有机混合物的操作的是( )
A.重结晶
B.萃取
C.蒸馏
D.蒸发
参考答案:分离、提纯液态有机混合物,常根据有机物的沸点不同,用蒸馏的方法分离,而重结晶、萃取、蒸发不能达到分离的目的,故选C.
本题解析:
本题难度:简单