微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
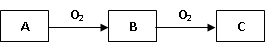
(1)若A是一种黄色单质固体,则B→C的化学方程式为?。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为?,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理?。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为?,C为?,(填写化学式)
实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式:??。
②写出C与水反应的化学方程式:??。
参考答案:(11分)(1)2SO2+O2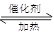 2SO3(2分)
2SO3(2分)
(2)过氧化钠(1分)? 2Na2O2+2CO2==2Na2CO3+O2(2分)
(3)① A: NH3,(1分)? C: NO2.(1分)
2NH4Cl+? Ca (OH) 2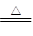 ?CaCl2 +2NH3↑+2H2O (2分)
?CaCl2 +2NH3↑+2H2O (2分)
② 3 NO2+ H2O= 2HNO3+ NO (2分)
本题解析:(1)若A是一种黄色单质固体,则A是S单质,属于B是二氧化硫,C是三氧化硫,则B→C的化学方程式为2SO2+O2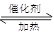 2SO3。
2SO3。
(2)若A是一种活泼金属,C是淡黄色固体,则A是钠,B是氧化钠,C是过氧化钠。过氧化钠能吸收CO2生成氧气,反应的化学方程式是2Na2O2+2CO2==2Na2CO3+O2。
(3)①若A为能使湿润的红色石蕊试纸变蓝的气体,则A应该是氨气。C是红棕色气体,且B和C易在空气形成光化学烟雾,这说明B是NO,C是NO2。实验室制取氨气的化学方程式是2NH4Cl+? Ca (OH) 2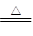 ?CaCl2 +2NH3↑+2H2O。
?CaCl2 +2NH3↑+2H2O。
②NO2与水反应的化学方程式是3 NO2+ H2O= 2HNO3+ NO。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础知识,侧重对学生基础知识的巩固个训练。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、填空题 (14分)已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。已知NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3,根据下列框图转化回答问题:
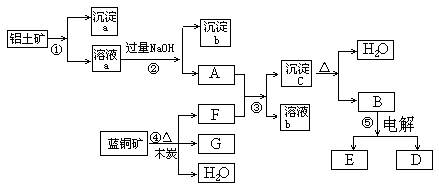
(1)?写出②的离子方程式:______________________、_____________________。
(2)?沉淀a、c化学成分分别是: ___? ___、__? ____。
(3)请写出检验沉淀b中所含有阳离子的实验方法_______________________________
(4)洗涤沉淀c的实验操作方法是____________________________________________
加热沉淀c应放在___________容器中进行。
(5)?经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:______________________、_________?___________________________________。
参考答案:(1) Al3++4OH—= AlO2—+2H2O? Fe3++3OH—=Fe(OH)3
(2)? SiO2?Al(OH)3
(3) 取沉淀少量于一支洁净的试管中,加入少量盐酸,然后再往试管中加入几滴的KSCN溶液,发现试管内呈现红色。
(4) 在漏斗内的沉淀上加入一定量的蒸馏水,没过沉淀,侍水自然流下,重复数次;坩埚?
(5)2 (2CuCO3·Cu(OH)2)+3C 6Cu+ 7CO2↑+2H2O? 2Al2O3
6Cu+ 7CO2↑+2H2O? 2Al2O3 4Al+3O2↑
4Al+3O2↑
本题解析:结合题目信息及框图可知:①加入的为足量的盐酸或硫酸,沉淀a为二氧化硅,溶液a为铁和铝的盐溶液,沉淀b为氢氧化铁;结合框图可得F为二氧化碳,G为铜,沉淀c为氢氧化铝,B为氧化铝。
本题难度:一般
3、推断题 下图涉及多种无机化工反应,所涉及物质都是由短周期元素组成的,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化肥,A、C、D、M均为常见元素的单质,“↑”表 示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2:1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出,洗净后加热分解可以得到B。
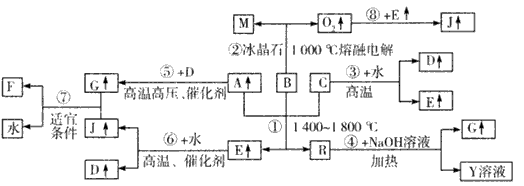
请回答下列问题:
(1)写出B的化学式:____ ,F的化学式:____ 。
(2)反应①的化学方程式为___。
(3)反应④的离子方程式为____ 。
(4)上述反应中属于非氧化还原反应的___(填写相应反应的序号)。
(5)Y溶液呈___性(填“酸”、“碱”或“中”),用离子方程式解释:____。
参考答案:(1) Al2O3?; CO( NH2)2
(2)N2 +Al2O3 +3C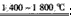 3CO +2AlN
3CO +2AlN
(3)AlN+OH- +H2O=AlO2-+NH3↑
(4)④⑦
(5)碱; AlO2-+2H2O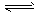 Al(OH) 3 +OH -
Al(OH) 3 +OH -
本题解析:
本题难度:一般
4、填空题 (11分)A、B、C、D均为中学化学所学的常见物质,且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他产物已略去):请填写下列空白:
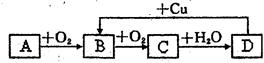
(1)若A为气体单质,则A为?,D→B的离子方程式为?
(2)若A为固体单质,则A为?,A主要用于制造?(任写两种)
(3)若A为气体化合物,其水溶液能使湿润的红色石蕊试纸变蓝,则实验室制取A的化学方程式为?。
(4)若A为气体化合物,其水溶液能使湿润的蓝色石蕊试纸变红,则A为?,A与B反应的化学方程式为?。
参考答案:(11分)
(1)N2?3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (3分)
(2)S?火药、硫酸(合理即给分)(3分)
(3)Ca(OH)2+2NH4Cl 2NH3↑+ CaCl2+2H2O?(2分)
2NH3↑+ CaCl2+2H2O?(2分)
(4)H2S? 2H2S+SO2=3S↓+2H2O(3分)
本题解析:略
本题难度:一般
5、填空题 下列框表中的A--L中是中学化学中常见的物质,所有物质均由短周期元素组成.已知常温、常压下,C为无色液体,D、E、L均为气体单质,H是一种可溶于盐酸和氢氧化钠溶液的白色固体,J是具有强氧化性的一元弱酸,A--L可发生如下转化:
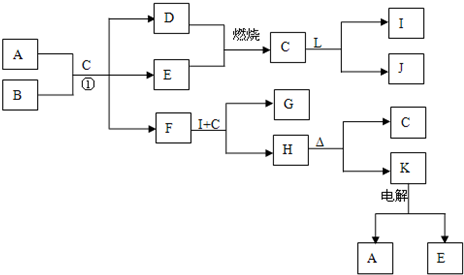
请回答下列问题:
(1)J的电子式______
(2)写出C、L反应转化为I和J的离子方程式______
(3)H是一种用于治疗胃酸过多的药物的主要成分,其治疗原理用离子方程式表示______
(4)写出F与I、C转化为G和H的离子方程式______
(5)如果A、B的物质的量之比为2:1,写出①的化学反应方程式______.
参考答案:常温、常压下,C为无色液体,应为H2O,则D、E为H2、O2中的一种,J是具有强氧化性的一元弱酸,应为HClO,则L为Cl2,I为HCl,H是一种可溶于盐酸和氢氧化钠溶液的白色固体,且能加热分解,则H为Al(OH)3,K为Al2O3,电解生成的E为O2,所以D为H2,F能和盐酸反应生成Al(OH)3,则F为NaAlO2,所以B为Na2O2,A、B和水混合时,分别生成H2、O2、NaAlO2,
NaAlO2和盐酸反应生成Al(OH)3和NaCl,则G为NaCl,则
(1)J是具有强氧化性的一元弱酸,应为HClO,电子式为
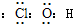
,故答案为:
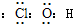
;
(2)氯气和水反应生成盐酸和次氯酸,其中次氯酸为弱酸,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Al(OH)3具有两性,与酸反应生成盐和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)NaAlO2和盐酸反应生成Al(OH)3和NaCl,反应的离子方程式为AlO2-+H++H2O=Al(OH)3↓,
故答案为:AlO2-+H++H2O=Al(OH)3↓;
(5)如果A、B的物质的量之比为2:1,根据元素质量守恒,可写出反应方程式为2Na2O2+4Al+6H2O=4NaAlO2+6H2↑+O2↑,
故答案为:2Na2O2+4Al+6H2O=4NaAlO2+6H2↑+O2↑.
本题解析:
本题难度:一般