微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后的产物再溶于水可得Z溶液,Y和Z溶液反应又可生成X,则盐X是?(?)。
A.(NH4)2SO4
B.NH4Cl
C.NH4NO3
D.NH4HCO3
参考答案:C
本题解析:盐X与烧碱混合共热,可放出无色气体Y,这说明X一定是铵盐,Y一定是氨气。氨气经一系列氧化后的产物再溶于水可得硝酸,硝酸和氨气反应生成硝酸铵,据此可知答案选C。
点评:化学推断题是一类综合性较强的试题,它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、填空题 下图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去)。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
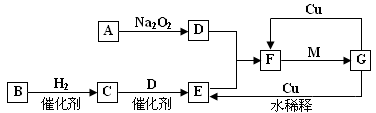
⑴ 物质F的化学式?。
⑵ 物质B的电子式?。
⑶ 写出C→E的化学方程式?。
⑷ 写出G→E的离子方程式?。
参考答案:(1)NO2
(2)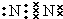
(3)4NH3?+ 5 O2 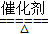 4NO + 6H2O
4NO + 6H2O
(4)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
本题解析:C是使湿润的红色石蕊试纸变蓝的气体,应为NH3,则B为N2,E为NO,G为HNO3,F为NO2,M是最常见的无色液体,应为H2O,A为可与过氧化钠反应的气体,应为CO2,则
(1)由以上分析可知F为NO2,故答案为:NO2;
(2)由以上分析可知B为N2,电子式为 ,故答案为:
,故答案为: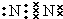 ;
;
(3)C为NH3,在催化作用下与氧气反应可生成NO,为工业制硝酸的重要反应,反应的化学方程式为4NH3?+ 5 O2 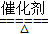 4NO + 6H2O,故答案为4NH3?+ 5 O2
4NO + 6H2O,故答案为4NH3?+ 5 O2 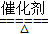 4NO + 6H2O。
4NO + 6H2O。
(4)G为HNO3,加水稀释成稀硝酸,可与铜反应生成NO,反应的化学方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
本题难度:一般
3、填空题 (12分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。

(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作?。
如何确定E中空气已被赶尽:__________________________________?。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为?。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________??
一段时间后,C中白色沉淀溶解,其原因是
________________________________________________________?
参考答案:(12分)(1)将装CaCO3的干燥管下移与稀HNO3反应产生CO2(2分);
当C处出现白色沉淀时(2分)
(2)3Cu+8H++2NO3- ="==" 3Cu2++2NO↑+4H2O(2分)
(3)用F向E中鼓入空气,E内颜色加深(2分);
3NO2+H2O=2HNO3+NO(2分);CaCO3 + 2HNO3=Ca(NO3)2+ H2O+CO2↑(2分)
本题解析:(1)要排尽装置中的空气,可以利用碳酸钙和酸反应产生的CO2来实现。所以操作是将装CaCO3的干燥管下移与稀HNO3反应产生CO2。因为CO2和石灰水反应能产生白色沉淀,所以当C处出现白色沉淀时,空气就已经被排尽。
(2)稀硝酸和铜生成NO、硝酸铜和水,方程式为3Cu+8H++2NO3- ="==" 3Cu2++2NO↑+4H2O。
(3)由于NO极易被氧气氧化,生成红棕色的NO2,据此可以判断。操作是用F向E中鼓入空气,E内颜色加深,即证明是NO,而不是氢气。由于NO2溶于水生成硝酸,硝酸能溶解碳酸钙,方程式为3NO2+H2O=2HNO3+NO(2分)、CaCO3 + 2HNO3=Ca(NO3)2+ H2O+CO2↑。
本题难度:一般
4、选择题 容积相同的四个集气瓶,分别装满下列气体,将其倒放在水槽中,充分作用后,集气瓶中进水最多的是?
A.NO
B.等体积NO2与O2的混合气
C.NO2
D.等体积NO与O2的混合气
参考答案:D
本题解析:A项NO不溶于水,故液面不会上升;先假设集气瓶的容积为V,B项中液面上升58V,C项中液面上升23V,D选项上升78V。因此D选项中集气瓶中进水最多,故选D项。
点评:本题需要对每个选项都进行计算,关键可以二氧化氮与水反应会生成一氧化氮,而一氧化氮遇到氧气又生成二氧化氮,如此可以写成一个总反应式来解答。
本题难度:一般
5、填空题 (14分)
已知铜在常温下能被浓HNO3溶解,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)请将上述反应改写成离子方程式?。
(2)NO2是一种?色的气体,在上述反应中作?(填“氧化”或“还原”)产物,而且是一种能与水反应的气体,其反应的化学方程式为?。
(3)上述反应中氧化剂与还原剂的物质的量之比为?,HNO3在反应中表现出?性和?性。
(4)若反应中生成1mol的NO2,则反应中转移?mol的电子,消耗Cu?g。
参考答案:(1) Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(2)红棕?还原? 3NO2↑+H2O=2HNO3+NO
(3)2∶1?氧化?酸? (4)1? 32
本题解析:略
本题难度:一般