微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作错误的是( )
A.分夜时,分夜漏斗中下层溶液从下口放出、上层溶液从上口到出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.可用酒精萃取碘水中的碘
D.称量时,称量物一般放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘
参考答案:C
本题解析:酒精和水是互溶的,所以选项C不正确,其余都是正确的,答案选C。
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L甲苯中,含有C-H键数目为8NA
B.t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA
C.在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1moL SO2转移电子数为5.5NA
D.50g 46%的乙醇水溶液中,含氢原子总数目为3NA
参考答案:C
本题解析:分析:A、甲苯在标准状况下不是气体;
B、依据溶度积常数和沉淀溶解平衡计算得到;
C、依据元素化合价升降变化,电子守恒计算得到电子转移;
D、乙醇溶液中氢元素存在水和乙醇中.
解答:A、甲苯在标准状况下不是气体,标准状况下,22.4L甲苯物质的量不是1mol,故A错误;
B、t℃时,MgCO3的Ksp=4×10-6,MgCO3的(s)?Mg2++2OH-,设镁离子浓度为x,则氢氧根离子浓度为2x,Ksp=c(Mg2+)×c2(OH-)=4x3=4×10-6,x=10-2mol/L,溶液体积不知不能计算微粒数,故B错误;
C、在反应4FeS2+11O2=2Fe2O3+8SO2中,依据氧气做氧化剂得到电子守恒计算得到,11mol氧气反应生成8molSO2,转移电子44mol,每生成1moL SO2转移电子数为5.5NA,故C正确;
D、50g 46%的乙醇水溶液中乙醇质量为23g,物质的量为0.5mol,溶液中含氢元素的还有水中,所以含氢原子总数目大于3NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,沉淀溶解平衡的计算应用,氧化还原反应电子转移计算,溶液中元素的存在形式分析判断,题目难度中等.
本题难度:困难
3、选择题 鉴别Na2SO4、Na2SO3、Na2CO3、NaCl的稀溶液,可以选用的一组试剂最好是
A.AgNO3、HNO3
B.BaCl2、HCl、Ca(OH)2
C.BaCl2、AgNO3
D.BaCl2、HCl、品红
参考答案:D
本题解析:四种物质都和硝酸银溶液反应产生白色沉淀,A不正确。由于SO2和CO2都是无色气体,都能使澄清的石灰水变混浊,所以应该用品红溶液鉴别SO2。因此正确的答案选D。
本题难度:一般
4、填空题 利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
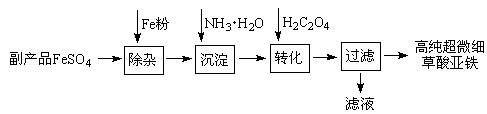
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有?。
(2)滤液经处理可得到副产品?。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为?。(写出计算过程)
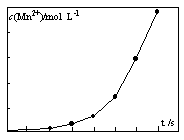
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为?。
参考答案:(1)NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解。(2分)
(2)(NH4)2SO4(2分)
(3)解:由题意知,C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
5? 2
n?20.4×10-3×0.2000mol
解得? n=0.0102mol? (4分)
(4)生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。(2分)
本题解析:(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解
(2)沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀的同时还有硫酸铵生成,所以副产品是(NH4)2SO4
(3)由题意知氧化C2O42-和Fe2+共消耗0.2000 mol·L-1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以C2O42-的物质的量为20.4×10-3×0.2000×5/2=0.0102mol;
(4)从图像上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中若温度不变,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
本题难度:一般
5、选择题 某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种组成,往溶液中加入烧碱溶液出现白色沉淀;或向原溶液中加入稀H2SO4也出现白色沉淀,并放出气体。据此分析下列组合判断中正确的是(? )
①肯定有BaCl2"②肯定有MgCl2"③肯定有NaHCO3"④肯定有Na2CO3或NaHCO3"⑤肯定没有MgCl2
A.①②③
B.①③
C.②④
D.①③⑤
参考答案:B
本题解析:根据原溶液中加H2SO4能产生白色沉淀且放出CO2,推断原溶液中一定存在BaCl2和NaHCO3,一定不存在Na2CO3;原溶液加入NaOH溶液时,发生反应:NaHCO3+NaOH===Na2CO3+H2O,Na2CO3+BaCl2===BaCO3↓+2 NaCl,因此根据原溶液加NaOH产生白色沉淀,不能确定是否存在MgCl2。
本题难度:一般