微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行
B.X2+的核外电子数目为18,则X在第四周期第ⅡA族
C.Li是最活泼金属,F是最活泼非金属
D.NaOH碱性比KOH强
参考答案:B
本题解析:
元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,但第Ⅷ族有三个纵行,所以元素周期表共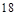 纵行,A错;
纵行,A错;
X2+的核外电子数目为18,则其原子序数为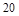 ,是
,是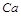 元素,在第四周期第ⅡA族,故B正确;
元素,在第四周期第ⅡA族,故B正确;
F元素的最外层有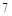 外电子,原子核对电子的引力很大,极易得到
外电子,原子核对电子的引力很大,极易得到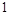 个电子达到最外层
个电子达到最外层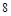 个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
个电子的稳定结构,是最活泼非金属.碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以Li不是最活泼金属,;故C错
碱金属随着核电核数的增加,原子半径逐渐增大,还原性增强,金属活性越来越强,所以碱性逐渐增强,故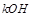 碱性比
碱性比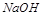 强,故D错
强,故D错
故正确答案为B
本题难度:一般
2、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
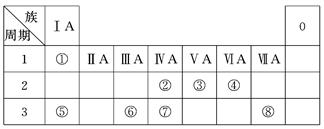
(1)④、⑤、⑥的原子半径由大到小的顺序是____________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(4)写出由②、③、④中的元素形成的等电子体分子?。(任写一组)
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2? b.FeCl3?c.Na2SO3?d.KMnO4
(6)由表中①、③、④三种元素形成盐的水溶液呈酸性,用离子方程式表示其原因:?;由表中①、②、③、④四种元素形成的一种盐的水溶液呈中性,该盐的化学式是?。
参考答案:(1)Na>Al>O(1分)
(2)HNO3>H2CO3>H2SiO3(1分)
(3)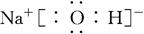 或
或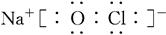 (2分)
(2分)
(4)N2 、CO(或N2O、CO2)(2分)
(5)ab(2分,漏选得1分,错选,多选均不得分)
(6)NH4++H2O NH3·H2O + H+ (2分)? CH3COONH4(2分)
NH3·H2O + H+ (2分)? CH3COONH4(2分)
本题解析:依据元素①~⑧在表中的位置可知,它们分别是H、C、N、O、Na、Al、Si、Cl。
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以④、⑤、⑥的原子半径由大到小的顺序是Na>Al>O。
(2)非金属性越强,最高价氧化物对应水化物的酸性越强。同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3。
(3)H、O、Na、Cl中的某些元素可形成既含离子键又含极性共价键的化合物可以是氢氧化钠或次氯酸钠等,其电子式为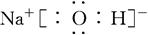 或
或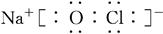 。
。
(4)原子数和价电子数分别都相等的是等电子体,则由C、N、O中的元素形成的等电子体分子是N2 、CO(或N2O、CO2)。
(5)两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,则该化合物是双氧水。其中可以起到催化剂作用的是MnO2、FeCl3,答案选ab。
(6)H、N、O三种元素形成盐的水溶液呈酸性,则该化合物是硝酸铵。硝酸铵溶于水电离出的NH4+水解溶液显酸性,离子方程式为NH4++H2O NH3·H2O + H+。H、C、N、O四种元素形成的一种盐的水溶液呈中性,该盐的化学式是醋酸铵。由于NH4+与CH3COO-的水解程度相同,因此溶液显中性。
NH3·H2O + H+。H、C、N、O四种元素形成的一种盐的水溶液呈中性,该盐的化学式是醋酸铵。由于NH4+与CH3COO-的水解程度相同,因此溶液显中性。
本题难度:一般
3、选择题 X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
参考答案:AC
本题解析:根据元素的结构和性质可知,X、Y、Z、R分别是C、O、Na、Cl。A正确,分别是CO和CO2;同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以B不正确,应该是Na、Cl、C、O;碳和氧形成的是极性键,钠和氧形成的是离子键,C正确;D不正确,由于Cl有+1价、+3价、+5价、+7价,所以NaClO、NaClO2、NaClO3、NaClO4,答案选AC。
本题难度:简单
4、选择题 香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电了数是次外层的3倍,T无正价,X与R原了序数之和是W的2倍。下列说法错误的是
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Z
D.XR2、WR2两化合物中R的化合价相同
参考答案:D
本题解析:Z的最外层电子数与次外层相等,则Z为Be,R最外层电了数是次外层的3倍,则R为氧,T无正价,故为氟,X和Z同主族,X为镁或钙,当为镁时,根据X与R原了序数之和是W的2倍,推出W为氖,不符合题意,当为钙时,推出W为硅,根据X、Y、Z为金属元素,推出Y为锂,故X、Y、Z、W、R、T分别为钙、锂、铍、硅、氧、氟;A、同周期,从左向右原子半径逐渐减小,故A正确;B、气态氢化物的稳定性甲烷大于硅烷,甲烷小于水,水小于氟化氢,故B正确;C、同主族最高价氧化物对应水化物的碱性从上到下逐渐增强,故C正确;在CaO2中氧元素显-1价,在SiO2中氧元素的化合价为-2价,D错误;故选D。
本题难度:一般
5、选择题 已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是
A.n=m+16
B.n=m+6
C.n=m+30
D.n=m+31
参考答案:D
本题解析:
分析:根据周期表的结构及每一周期元素的数目.
解:周期表中第一、二、三、四、五、六、七周期元素的种数分别为2、8、8、18、18、32、26,若元素在二、三周期,则原子序数n=m+6,若元素在四、五周期,由于副族和ⅥⅡ族出现在ⅠA和ⅦA族之间共10种元素,则原子序数n=m+6+10=m+16,若元素在第六周期,又多了镧系的出现,有15种元素,则原子序数n=m+16+14=m+30.
故选:D.
本题难度:简单