微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某溶液中大量存在以下五种离子:NO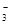 、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO
、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO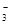 )︰n(SO42—)︰n(Fe3+)︰n(H
)︰n(SO42—)︰n(Fe3+)︰n(H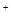 )︰n(M)=2︰3︰1︰3︰1,则M可能是下列中的
)︰n(M)=2︰3︰1︰3︰1,则M可能是下列中的
A.Fe2+
B.Cu2+
C.Al3+
D.Ba2+
参考答案:B
本题解析:根据溶液中电荷守恒,则M是Cu2+。所以正确选项为B。
本题难度:一般
2、选择题 向Cu和Cu2O的混合物27.2g中加入某浓度的硝酸0.1L,固体物质完全反应,生成NO2、 N2O4、NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,溶液恰好呈中性,金属离子也已完全沉淀,沉淀质量为39.2g。以下所得结论不合理的是
A.硝酸的物质的量浓度为12.0mol/L
B.产生的气体在标准状况下的体积为13.44L
C.Cu与Cu2O 的物质的量之比为2:1
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
参考答案:AB
本题解析:在所得溶液中加入1.0mol/L?的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,沉淀为Cu(OH)2,质量为39.2g,物质的量为39.2g÷98g/mol=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,故反应中硝酸有剩余。A、混合气体中N2O4的含量不确定,不能确定起氧化剂作用的硝酸的物质的量,不能确定原溶液中硝酸的物质的量,故该硝酸的浓度不能确定,故A错误;B、假定生成气体只有NO,体积最大,假定生成的气体只有N2O4,气体的体积最少,混合气体中N2O4的含量不确定,不能确定具体的体积,故B错误;C、设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量有 64x+144y=27.2,根据铜元素守恒有x+2y=0.4,联立方程解得x=0.2,y=0.1,所以n(Cu):n(Cu2O)=0.2:0.1=2:1,故C正确;D、反应后的溶液中加入氢氧化钠溶液,氢氧化钠与硝酸铜反应,剩余的氢氧化钠与硝酸反应,最后为硝酸钠溶液,根据氮元素守恒可知反应后溶液中n(HNO3)+ 2n[Cu(OH)2]=n(NaNO3),所以n(HNO3)=n(NaNO3)-2 n[Cu(OH)2]=1mol-2×0.4mol=0.2mol,故D正确,答案选AB。
本题难度:一般
3、选择题 (3分)如图为某市售盐酸试剂瓶标签上的部分数据.则该盐酸的物质的量浓度是( )
盐酸
化学式:HCl
相对分子质量:36.5
密度:1.18g/cm3
HCl的质量分数:36.5%
符合GB622
|
参考答案:
本题解析:
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数,下列叙述正确的是?
A.标准状况下,22.4 L H2O含有的分子数为1 NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl - 个数为1 NA
参考答案:B
本题解析:略
本题难度:简单
5、计算题 闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是________。
(3)若将ZnS溶于强酸可产生硫化氢气体。在120 oC、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数。(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
参考答案:(1)0.93 (3分)
(2)S?(3分)
(3)60%或70% (4分)
(4)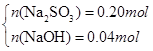 ?
?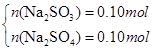
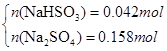 ?
?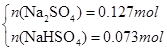 ?(4分)
?(4分)
本题解析:(1)解析:设闪锌矿中ZnS的质量为x,杂质为y
2ZnS+3O2="2" ZnO+2SO2
x/97?x/97
有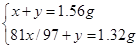
解得x=1.455g,y=0.105g,所以样品中w(ZnS)=1.455g÷1.56g×100%=93%
(2)解析:设浓硫酸被还原的产物中S的化合价为x。
根据题意过量的硫酸用碱滴定,则过量的硫酸n(H2SO4)= n(NaOH)×1000/15="0.25" mol/L×0.02170 L×1000/15=0.1808mol,所以反应的硫酸n(H2SO4)="18.4" mol/L×0.012L-0.1808mol=0.04mol,又反应后溶液为硫酸锌,所以n(ZnSO4)= n(Zn)="1.95" g÷65g/mol=0.03mol,所以作酸的硫酸n(H2SO4)= n(ZnSO4)=0.03mol,做氧化剂硫酸n(H2SO4)=0.04mol-0.03mol=0.01mol,因为Zn反应0.03mol失去0.06mol电子,所以根据得失电子守恒,(+6-x) ×0.01mol=0.06mol,解得x=0,所以还原产物中S的化合价为0价,还原产物为S单质。
(3)解析:在120 oC、1 atm下,设硫化氢和氧气体积分别为x、y,点燃生成的都是气态产物,由于比例不定,
所以若氧气过量,则有:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)
2? 3?2?2
x? y?x?x
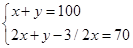
解得x=60ml,y=40ml;所以此时硫化氢的百分数为60ml÷100ml×100%=60%
若硫化氢过量,则有:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)
2? 3?2?2
x? y?2/3y?2/3y
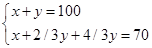
解得x=10ml,y=90ml;此时得到数据不满足条件舍去。
(4)解析:n(SO2)=0.2mol,通入未知浓度的NaOH溶液,若NaOH溶液过量则所得溶液为Na2SO3 、NaOH;若恰好完全反应则所的溶液为Na2SO3 溶液;若SO2稍过量则所得溶液为Na2SO3?、NaHSO3 ;若SO2过量恰好完全被吸收则生成NaHSO3 溶液;
(1)若所得溶液为Na2SO3 、NaOH:则有n(Na2SO3)= n(SO2)=0.2mol,则m(Na2SO3)=25.2g<26.8g,
蒸干后若得到的是Na2SO3 、NaOH时,满足条件,此时m(NaOH)= 26.8g-25.2g=1.6g,即n(NaOH)=0.04mol.
(2)若恰好完全反应所得溶液为Na2SO3 :因n(Na2SO3)= n(SO2)=0.2mol,则m(Na2SO3)=25.2g<26.8g,蒸干后必有部分Na2SO3 被氧化为Na2SO4 ;设n(Na2SO3)=x,n(Na2SO4)=y,则有:
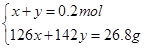
解得x=0.1mol,y=0.1mol即n(Na2SO3)=0.1mol,n(Na2SO4)= 0.1mol.
(3)若SO2稍过量所得溶液为Na2SO3?、NaHSO3 :当蒸干后固体全为Na2SO3时,m(Na2SO3)=25.2g<26.8g,所以蒸干溶液后所得晶体不可能是Na2SO3?、NaHSO3 组合;当蒸干后固体全为Na2SO4 时,m(Na2SO4)="0.2mol×142g/mol=28.4g" >26.8g,所以蒸干后不可能全是Na2SO4,可以是Na2SO4 和NaHSO3或者是Na2SO4 和NaHSO4 ,因此有
设n(NaHSO3)=x,n(Na2SO4)=y
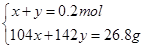
解得x=0.042mol,y=0.158mol即n(NaHSO3)= 0.042mol,n(Na2SO4)= 0.158mol
设n(NaHSO4)=x,n(Na2SO4)=y
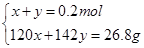
解得x=0.073mol,y=0.127mol即n(NaHSO3)= 0.073mol,n(Na2SO4)= 0.127mol
(4)若SO2过量恰好被吸收所得溶液为NaHSO3 :则蒸干后所得固体无论是NaHSO3 还是NaHSO4 或者二者混合,都不可能。
本题难度:困难