微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去下列物质中所含少量杂质(括号内为杂质),所选试剂和分离方法能达到实验目的是
[? ]
混合物?
试剂
分离方法
A.
乙烷(乙烯)?
高锰酸钾溶液
洗气
B.
甲苯(苯酚)?
溴水
过滤
C.
乙醇(水)
氧化钙
蒸馏
D.
乙酸乙酯(乙酸)?
NaOH溶液
分液
参考答案:C
本题解析:
本题难度:一般
2、填空题 鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选作鉴别的试剂有(填编号,可多选)_________。
A.BaCl2溶液? B.Mg(NO3)2溶液? C.Na2CO3溶液
②鉴别反应的离子方程式:_________________________。
(2)饱和碳酸钠溶液、澄清石灰水
①可选用鉴别的试剂有(填编号,可多选)____。
a.盐酸? b.NaCI? c.硝酸? d.BaCl2溶液
②依次写出鉴别中有明显现象的反应的离子方程式:________________________________。
参考答案:(7分)?(1)①A?(1分)②Ba2++SO42-=BaS04↓ (1分)
(2)① a.? c.? d. (3分)②CO32-+2H-=CO2↑+H2O(1分)Ba2++CO32- =BaCO3↓ (1分)
本题解析:(1)①可用BaCl2溶液鉴别硫酸和稀盐酸,前者产生白色沉淀,后者不反应。Mg(NO3)2溶液与稀硫酸、稀盐酸不反应,稀硫酸、稀盐酸与Na2CO3溶液反应都产生气体,不能鉴别,故答案为:A;
②稀硫酸和BaCl2溶液发生反应的离子方程式为Ba2++SO42-=BaSO4↓。
(2)①碳酸钠溶液可与盐酸、硝酸反应生成气体,与BaCl2溶液反应生成沉淀,饱和碳酸钠溶液、澄清石灰水与NaCl溶液不反应,不能鉴别,故答案为:acd;
②鉴别中有明显现象的反应的离子方程式为Ba2++CO32-=BaCO3↓;2H++CO32-=CO2↑+H2O。
本题难度:一般
3、选择题 下列各组溶液,不另加其他试剂就可以将它们分别开的是C
A.NaCl, HCl, NaAlO2, NaHCO3
B.Na2SO4, KNO3,(NH4)2SO4,MgCl2
C.FeCl3, NaOH, AlCl3, HNO3
D.AgNO3, NaCl, Na2SO4, NaI
参考答案:C
本题解析:略
本题难度:简单
4、填空题 (14分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2和炭粉,用A制备高纯MnCO3,的流程图如下。
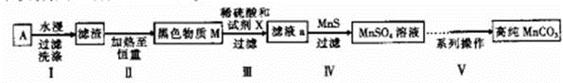
(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)?
(4)为选择试剂X,在相同条件下,分别用5 g黑色物质M进行制备MnSO3的实验,得到数据如右表:

①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为_________。
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.7。请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂: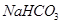 、乙醇)
、乙醇)
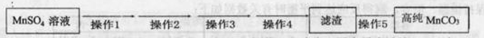
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净; 操作4:___________________;
操作5:低温烘干。
(6)操作1可能发生反应的离子方程式?
参考答案:(14分,每空2分)
(1)Zn
(2)除去碳粉
(3)Zn2++MnS=ZnS+Mn2+
(4)①30%的过氧化氢?②H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑
(5)加入NaHCO3,控制pH<7.7;?用少量无水乙醇洗涤2~3次
(6)Mn2++2 HCO3-= MnCO3↓+H2O+CO2↑
本题解析:(1) 碱性锌锰干电池中,锌比锰活泼,所以负极材料是Zn;
(2)第I步操作水浸后,溶于水的NH4CI、ZnCI2可除去,而碳粉不溶于水,所以第Ⅱ步操作的目的是除去碳粉;
(3)第Ⅳ步操作中加入MnS目的是利用沉淀的转化除去Zn2+,使MnS转化为更难溶的ZnS,离子方程式为Zn2++MnS=ZnS+Mn2+
(4)①根据表中数据选择30%的过氧化氢得到的MnSO4的质量最多,所以选择30%的过氧化氢;
②根据表可知,过氧化氢是把二氧化锰转化为硫酸锰,本身被氧化为氧气,化学方程式为H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑
(5)最终产物是碳酸锰,所以第一步应加入NaHCO3,调节pH值使之小于7.7,防止氢氧化锰生成;MnCO3潮湿时易被空气氧化,所以水洗完后再用用少量无水乙醇洗涤2~3次以除去碳酸锰表面的水分;
(6)操作1目的是生成碳酸锰的沉淀,所以可能发生反应的离子方程式Mn2++2 HCO3-= MnCO3↓+H2O+CO2↑
本题难度:困难
5、实验题 请你设计至少两种方法除去细小的铁颗粒中混有的细小的铝颗粒。(简要说明)
_______________________________________________
参考答案:方法一:可以使用NaOH溶液洗涤混合物,铁与NaOH溶液不发生反应,而Al可溶于NaOH溶液。
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,经过滤、洗涤可以得到铁。
方法二:可以使用磁铁将混合物中的铁吸引出来而留下杂质铝。
本题解析:
本题难度:一般