微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:25℃时,Ka(HAc)=1.7×10-5 mol /L。现有如下溶液:
①0.1mol/LHAc与0.1mol/LNaOH溶液等体积混合液
②pH = 3的HAc与pH = 11的NaOH溶液等体积混合液
③0.1 mol /LH2SO4与0.2mol/LNaOH溶液等体积混合液
常温时,三者pH大小关系正确的是
A.①>③>②
B.③>①>②
C.①>②>③
D.②>③>①
参考答案:A
本题解析:NaOH是强碱,HAc是弱酸。①0.1mol/LHAc与0.1mol/LNaOH溶液等体积混合液时恰好完全发生反应得到NaAc。由于NaAc是强碱弱酸盐。在溶液中Ac-发生水解反应。Ac-+H2O HAc+ OH-。所以溶液显碱性。②pH = 3的HAc溶液c(H+)=10-3mol/L,由于HAc是弱酸,部分电离,所以c(HAc) >10-3mol/L pH = 11的NaOH溶液,c(OH -)=10-3mol/L。若二者等体积混合液则溶液为NaAc和HAc的混合溶液。由于HAc的电离作用大于Ac-水解作用,所以溶液显酸性。③0.1 mol /LH2SO4与0.2mol/LNaOH.因为H2SO4是二元强酸,NaOH是一元强碱,所以量溶液中的c(OH-)= c(H+)若等体积混合液,则n(OH-)=n(H+).因此溶液显中性。常温时,三者pH大小关系正确的是①>③>②。选项为A。
HAc+ OH-。所以溶液显碱性。②pH = 3的HAc溶液c(H+)=10-3mol/L,由于HAc是弱酸,部分电离,所以c(HAc) >10-3mol/L pH = 11的NaOH溶液,c(OH -)=10-3mol/L。若二者等体积混合液则溶液为NaAc和HAc的混合溶液。由于HAc的电离作用大于Ac-水解作用,所以溶液显酸性。③0.1 mol /LH2SO4与0.2mol/LNaOH.因为H2SO4是二元强酸,NaOH是一元强碱,所以量溶液中的c(OH-)= c(H+)若等体积混合液,则n(OH-)=n(H+).因此溶液显中性。常温时,三者pH大小关系正确的是①>③>②。选项为A。
本题难度:一般
2、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下旬问题:
(1)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为下图所示:

①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___________________ ,
②反应结束后所得两溶液中,c(CH3COO-)__________c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈__________________ ,列式并说明得出该常数的理由________________ 。
(3)4.0×10-3 mol/LHF溶液与4.0×10-4 mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。_____________________________
参考答案:(1)①相同的起始条件,只能是因为两种酸的电离度不同导致溶液中起始反应时H+浓度不同引起反应速率的不同;②<。
(2)Ka=0.4×10-3;HF电离平衡常数Ka= c(H+)·c(F-)/ c(HF),其中c(H+)、 c(F-)、 c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4, c(F-)=1.6×10-3、 c(HF)=4.0×10-4。
(3)PH=4.0,则c(H+)=10-4,此时:根据HF电离,产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10, 5.12×10-10大于Kap(CaF2)=1.5×10-10,此时有少量沉淀产生。
本题解析:
本题难度:一般
3、填空题 (6分)下列10种物质中:①NaOH溶液②H2SO4③硫酸铜晶体④Cu ⑤CH3COOH ⑥NaOH固体⑦蔗糖⑧石灰水⑨水银⑩氨水
能导电的有 ;属于强电解质的有 ;属于弱电解质的有 。
参考答案: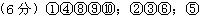
本题解析:略
本题难度:简单
4、选择题 下列关于盐酸与醋酸两种稀溶液的说法正确的是
[? ]
A.相同浓度的两溶液中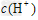 相同
相同
B.100mL?0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,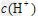 均明显减小
均明显减小
参考答案:B
本题解析:
本题难度:一般
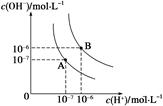
5、填空题 (1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
化学式
| 电离平衡常数(25 ℃)
|
HCN
| K=4.9×10-10
|
H2CO3
| K1=4.3×10-7、K2=5.6×10-11
|
参考答案:(1)1×10-11、 < 、 促进 (2) 2 、 5% (3)NaCN+H2O+CO2=HCN+NaHCO3
本题解析:(1)由图中曲线可知,25℃时水的离子积Kw = c(H+) × c(OH-)=10-14 ,95℃时水的离子积Kw = c(H+) × c(OH-)=10-12 ,Kw(25 ℃)> Kw(95℃),且95℃的氢氧化钠溶液中,当c(OH-)="0.1" mol·L-1 时,由水电离的c(H+) =10-12 /0.1 mol·L-1 =10-11 ;往水中加水解的盐,将促进水的电离。
(2)因为HA为一元酸,所以有0.001molHA电离,则C(H+)="0.001mol÷0.1L=0.01" mol/L,所以pH=-lgC(H+)=2,电离度α=n电离/n总="0.001" mol÷(0.1L×0.2 mol/L) ×100%=5%。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量,所以酸的电离常数越大,则说明该酸酸性越强。所以从右表数据可知,酸性比较:H2CO3 >HCN>HCO3- ,所以根据强酸制弱酸原理,往NaCN溶液中通入少量CO2 发生的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3 。
考点:本题主要考查的是水的离子积常数的影响因素。
本题难度:一般