微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某酯经水解后可得酸A及醇B,醇B经过氧化后可得A,该酯可能是
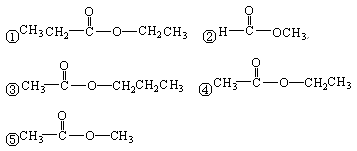
A.②④
B.①③④
C.①③⑤
D.④⑤
参考答案:A
本题解析:试题分析:酯经水解后可得酸A及醇B,醇B经过氧化后可得A,这说明A和B中碳原子数是相同的,①③⑤不正确,所以正确的答案选A。
考点:考查酯类水解以及羟基、醛基和羧基之间的转化
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是熟练掌握醇、醛和羧酸之间官能团的转化关系和原理,然后结合题意灵活运用即可,有助于培养学生的逻辑思维能力和发散思维能力。
本题难度:困难
2、填空题 (1)写出Na2CO3在水溶液中电离的电离方程式 。
(2)在3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O的反应中,作为氧化剂的物质是 (填化学式);用双线桥法,标出该氧化还原反应的电子转移情况和数目。
(3)在一定条件下,RO3n-和氯气可发生如下反应:
RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O 由以上反应可知RO3n-被 (填“氧化”或“还原”), RO3n-中元素R的化合价是 。
参考答案:(1)Na2CO3=2Na + + CO32-
(2)HNO3 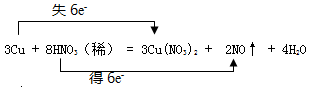
(3)氧化; +4
本题解析:(1)碳酸钠强电解质,Na2CO3在水溶液中电离的电离方程式为Na2CO3=2Na + + CO32-
(2)3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O,该反应硝酸的氮元素由+5价降低到+2价,硝酸是氧化剂,双线桥法标出该氧化还原反应的电子转移情况和数目是,
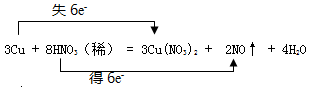
(3)由电荷守恒可知n=2,则RO32-中的R由+4价升高到+6价,发生了氧化反应。
考点:考查电离方程式的书写,氧化还原反应等知识。
本题难度:一般
3、选择题 下列说法中正确的是
A.硫酸钡难溶于水,但硫酸钡属于强电解质
B.氯化钠水溶液在电流的作用下电离出Na+和Cl-
C.硫酸钠在水中的电离方程式可表示为Na2SO4==2Na++S6++4O2-
D.盐酸能导电,故盐酸属于电解质
参考答案:A
本题解析:A正确,硫酸钡虽然难溶于水,但在熔融状态下可以完全电离,属于强电解质.
B错误,电离不需要通入电流.
C错误,正确的应该为: Na2SO4==2Na++SO42-
D错误,盐酸是混合物,不属于电解质,也不属于非电解质.
本题难度:简单
4、选择题 曾对化学平衡进行研究并提出平衡移动原理的化学家是
A.勒夏特列
B.门捷列夫
C.道尔顿
D.拉瓦锡
参考答案:A
本题解析:勒夏特列提出平衡移动原理
门捷列夫提出元素周期律
道尔顿提出原子结构学说
拉瓦锡研究空气中氧气的含量
本题难度:一般
5、选择题 已知: 2Zn(s)+O2(g)=2ZnO(s)?△H=-701.0kJ·mol-1?
2Hg(l)+O2(g)=2HgO(s)?△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A.519.4kJ·mol-1
B.259.7 kJ·mol-1
C.-259.7 kJ·mol-1
D.-519.4kJ·mol-1
参考答案:C
本题解析:试题分析:根据盖斯定律可知,(①-②)÷2即得到反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l),所以该反应的△H=(-701.0kJ/mol+181.6 kJ/mol)÷2=-259.7 kJ/mol,答案选C。
考点:考查盖斯定律的应用
点评:该题是基础性试题的考查,元素高考中的常见考点和题型。主要是考查学生灵活运用盖斯定律解决实际问题的能力,也有了培养学生的逻辑推理能力,同时也有助于提高学生的应试能力和学习效率。
本题难度:困难