微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在化学反应中,如果反应前后元素的化合价发生变化,就一定有______转移,这类反应就属于______反应.元素化合价升高,表明该元素的原子______电子,含该元素的物质发生______反应,这种物质是______剂;例如在Fe3O4+4CO
3Fe+4CO2的中,是氧化剂,______是还原剂.
参考答案:氧化还原反应的特征是有元素的化合价发生变化,实质是电子转移,有化合价变化的反应是氧化还原反应,化合价升高元素失电子,被氧化,发生氧化反应,含有该元素的反应物是还原剂,化合价降低元素得到电子,被还原发生还原反应,含有该元素的反应物是氧化剂,故答案为:电子;氧化还原;失;氧化;还原;Fe3O4;CO.
本题解析:
本题难度:一般
2、选择题 元素R有如下反应:RO3-+5R-+6H+═3R2+3H2O,下列说法正确的是( )
A.元素R位于周期表中第ⅤA族
B.RO3-中的R只能被还原
C.R2在常温常压下一定是气体
D.每反应消耗1molRO3-,转移电子的物质的量为5mol
参考答案:A、根据R元素的一种离子R-,可知其元素的最高价为+7价,元素R位于周期表中第ⅤⅡA族,故A错误;
B、RO3-中R元素的化合价为+5价,最高价是+7价,所以RO3-中的R既能被还原又能被氧化,故B错误;
C、周期表中第ⅤⅡA族的溴单质是液态,故C错误;
D、反应RO3-+5R-+6H+═3R2+3H2O中,R元素的化合价为+5价,降为0价,化合价降低5,所以转移电子数为5,即每反应消耗1molRO3-,转移电子的物质的量为5mol,故D正确.
故选D.
本题解析:
本题难度:简单
3、简答题 写出下列反应的双线桥,需指明氧化剂和还原剂,以及得失的电子数.
(1)2KClO3
2KCl+O2↑
(2)4P+5O22P2O5.
参考答案:(1)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,氧化剂和还原剂都是KClO3,转移电子数为12,用双线桥表示其电子转移情况为: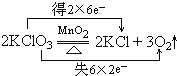 ,
,
故答案为: ;
;
(2)反应中P元素化合价由0价升高到+5价,O元素化合价由0价降低到-2价,氧化剂为O2,还原剂为P,用双线桥表示其电子转移情况为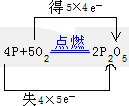 ,
,
故答案为: .
.
本题解析:
本题难度:简单
4、填空题 实验室可用KMnO4和浓盐酸反应制取氯气.其变化可表述为:
______KMnO4+______HCl(浓)═______KCl+______MnCl2+______Cl2↑+____________
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内).
(2)请将上述配平的化学方程式改写为离子方程式______.
(3)浓盐酸在反应中显示出来的性质是______(填写编号,多选倒扣).
①只有还原性?②还原性和酸性
③只有氧化性?④氧化性和酸性
(4)产生0.1molCl2,则转移的电子的物质的量为______mol.
(5)ClO2具有很强的氧化性.因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数来衡量)是Cl2的______倍.
参考答案:(1)元素化合价的变化分别为:Mn元素由KMnO4的+7价变成MnCl2中的+4价,化合价降低,所以KMnO4是氧化剂,一个KMnO4得5个电子生成MnCl2;
Cl元素由?HCl中的-1价变成Cl2中的0价,化合价升高,所以?HCl是还原剂,生成一个Cl2分子需失2个电子;
根据氧化还原反应中得失电子数相等,其最小公倍数是10,所以得到10mol电子需要5mol高锰酸钾参加反应,失去1omol电子需要10molHCl参加氧化还原反应,再根据原子守恒,判断其它物质的计量数.
故答案为:2;10; 2;2;5;8
?(2)单质、弱电解质写化学式,强电解质写离子,故答案为:2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O
(3)通过以上分析知,盐酸起还原剂的作用;盐酸是强酸,能和金属氧化物反应生成盐和水,所以起酸的作用.
故选:②
(4)2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O?转移电子
? 5mol? 10mol
?0.1mol? 0.2mol
故答案为:0.2mol
(5)Cl2、ClO2作消毒剂时,其还原产物均为Cl-.根据得电子能力得:
5NA67.5:2NA71=2.63
故答案为:2.63
本题解析:
本题难度:一般
5、选择题 已知只有浓盐酸与MnO2在加热的条件下才能反应产生C12,稀盐酸与MnO2不反应.请问在课堂上做演示实验时,用下列两种方法制取C12:①用含HCl?146g的浓盐酸与174g?MnO2反应;②用87g?MnO2与足量的浓盐酸反应,则所得C12( )
A.①比②多
B.②比①多
C.一样多
D.无法比较
参考答案:反应的化学方程式为:4HCl(浓)+MnO2?△?.?MnCl2+Cl2↑+H2O,
①n(HCl)=146g36.5g/mol=4mol,n(MnO2)=174g87g/mol=2mol,
浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol;
②n(MnO2)=87g87g/mol=1mol,由于浓盐酸足量,生成的n(Cl2)=1mol,
所以所得C12②比①多,
故选B.
本题解析:
本题难度:一般