微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一处于平衡状态的反应:X(g) + 3B(g) 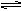 ?2Z(g) △H<0 ,为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
?2Z(g) △H<0 ,为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
①高温?②低温?③高压?④低压?⑤加正催化剂?⑥除去Z
A.①③⑤
B.②③⑤
C.②③⑤⑥
D.②③⑥
参考答案:D
本题解析:该反应是体积减小的、放热的可逆反应。所以选项D正确,①④向逆反应方向移动,⑤平衡不移动。答案选D。
本题难度:一般
2、填空题 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
难溶物
| Ksp
|
Ca3(AsO4)2
| 6.8× 10-19 10-19
|
AlAsO4
| 1.6×1 0-16 0-16
|
FeAsO4
| 5.7×10-21
|
污染物
| H2SO4
| As
|
浓度
| 28.42 g/L
| 1.6 g·L-1
|
排放标准
| pH 6~9
| 0.5 mg·L-1
|
表1.几种砷酸盐的Ksp?表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=? ▲?mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=? ▲?,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是? ▲?mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式? ▲?。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为? ▲?;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为? ▲?。
参考答案:
⑴0.29
⑵c3 (Ca2+)·c2 (AsO43-)? 5.7×10-17
⑶2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
⑷①CaSO4?②H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀
本题解析:
略
本题难度:简单
3、填空题 (12分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
t℃
| 700
| 800
| 850
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
请回答:
(1)上述反应中Q?0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是?。
a. 容器中压强不变? b. 反应热不变? c. v正(H2) =v逆(CO)? d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
时间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c 2
| c 3
| c 3
|
4
| c 1
| c 2
| c 3
| c 3
|
5
| 0.116
| 0.216
| 0.084
| ?
|
6
| 0.096
| 0.266
| 0.104
| ?
|
①计算:3 min时CO的浓度c 1 =?mol/L,H2O (g)的转化率=?。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是?表中5min~6min之间数值发生变化,可能的原因是?
a . 增加水蒸气? b. 降低温度? c. 使用催化剂? d. 增加氢气浓度
参考答案:(1)>? (2)? c d? (3) 0.08? 40%? (4) d? a
本题解析:(1)由表中数据,随温度的升高,K增大,即该反应的正反应方向为吸热反应,Q>0;
(2)能判断该反应已达到化学平衡状态的依据是:cd;a错,该反应为等体积反应,无论平衡与否容器内压强不变;b错,对于某一具体的反应来说,反应热为一常数;
(3)①3 min时该反应已达平衡则,
由化学反应方程式CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.200? 0.300? 0? 0
变化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)0.2—x? 0.3—x? x? x
850℃时该反应的平衡常数 ,解得x=0.12;
,解得x=0.12;
即可得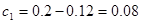 ;H2O (g)的转化率
;H2O (g)的转化率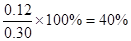 ;
;
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是增加氢气浓度,表中5min~6min之间数值发生变化,可能的原因是增加水蒸气;
本题难度:一般
4、选择题 反应4A(g)+5B(g)==4C(g)+4D(g)在0.5L密闭容器中进行,30s后A减少了0.90mol,则此反应的速率可表示为
[? ]
A.v(A)= 0.030mol/(L ·s)
B.v(B)=0.075mol/(L· s)
C.v(C)=0.030mol/(L· s)
D.v(D)=0.030mol/(L· s)
参考答案:B
本题解析:
本题难度:一般
5、选择题 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是?

[?]
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始时10s,X的物质的量浓度减少了0.79mol/L
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)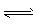 Z(g)
Z(g)
参考答案:C
本题解析:
本题难度:一般