微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法或方程式正确的是(?)
A.用催化法处理汽车尾气中的CO和NO:CO+NO C+NO2
C+NO2
B.NO2与水的反应:
C.NH4HCO3溶于过量的NaOH溶液中:
D.在1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、 一定能大量共存
一定能大量共存
参考答案:B
本题解析:NO2为污染性气体,是引起光化学烟雾的物质之一,用催化剂处理汽车尾气中的CO和NO不再生成污染性气体,发生的反应为:2NO+2CO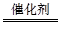 ?2CO2+N2,A错; C项,
?2CO2+N2,A错; C项,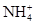 也能与OH-发生反应,C错;D项,
也能与OH-发生反应,C错;D项,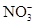 与H+组合成HNO3能将Fe2+氧化,不能大量共存,D错。
与H+组合成HNO3能将Fe2+氧化,不能大量共存,D错。
本题难度:一般
2、选择题 某溶液中加入铝粉有氢气产生,该溶液中一定能大量共存的离子组是 (? )
A.Na+、NO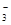 、Cl-、SO
、Cl-、SO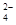
B.Na+、K+、Ba2+、HCO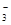
C.Fe2+、NH4+、NO3?、Cl-
D.Na+、K+、Cl-、SO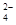
参考答案:D
本题解析:离子间如果发生化学变化,则不能大量共存,反之是可以的。某溶液中加入铝粉有氢气产生,说明该溶液可能显酸性,也可能显碱性。A中如果显酸性,则在酸性条件下NO3-和铝反应得不到氢气;B中HCO3-和H+或OH-都反应,得不到不能大量共存;C中如果显碱性,Fe2+、NH4+不能大量共存;如果显酸性,则在酸性条件下NO3-和Fe2+发生氧化还原反应,因此正确的答案选D。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单
3、选择题 实验室配制一种仅含四种离子(不包括水电离的离子)的无色混合溶液,且要求混合溶液中四种离子的浓度均相等,下列选项能达到要求的是( )
A.Cu2+、NH4+、SO42-、NO3-
B.Ca2+、Al3+、NO3-、Cl-
C.Na+、Mg2+、SO42-、I-
D.H+、HCO3-、K+、F-
参考答案:A.Cu2+有颜色,如溶液无色不符,故A错误;
B.溶液无色,但四种离子的浓度均相等时,溶液电荷不守恒,故B错误;
C.溶液无色,四种离子的浓度均相等时,溶液电荷守恒,且离子之间不发生任何反应,能共存,故C正确;
D.H+与HCO3-、F-不能大量共存,不能达到实验要求,故D错误.
本题解析:
本题难度:简单
4、选择题 NaHSO4在熔融态或者溶于水时都存在的离子是:
A.Na+
B.H+
C.HSO4-
D.SO42-
参考答案:A
本题解析:略
本题难度:一般
5、选择题 下列描述正确的是( )
A.在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存
B.MgO可以除去MgCl2溶液中的FeCl3
C.足量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++2H2O+NO↑
D.对于平衡体系:H2(g)+I2(g)?2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深放电充电
参考答案:A.在pH=1溶液中存在大量氢离子,ClO-与氢离子反应生成次氯酸,在溶液中不能大量共存,故A错误;
B.氯化铁溶液中铁离子水解生成氢氧化铁胶体和氯化氢,加入氧化镁可以促进铁离子水解,反应产物为氯化镁,没有引进杂质,且能够除去杂质氯化铁,故B正确;
C.足量铁粉与稀硝酸反应,反应产物应该为亚铁离子,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++4H2O+2NO↑,故C错误;
D.该反应前后气体体积相等,改变压强后化学平衡不发生移动,故D错误;
故选B.
本题解析:
本题难度:简单