微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为
A.6 :3 :2
B.3 :2 :1
C.6 :3 :1
D.1 :2 :3
参考答案:A
本题解析:生成的沉淀即氯化银物质的量相等,说明氯化钠、氯化镁、氯化铝中Cl?物质的量相等,设Cl?物质的量为nmol,则氯化钠的物质的量为nmol,氯化镁的物质的量为1/2nmol,氯化铝的物质的量为1/3nmol,三种溶液体积相同,所以原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为n:1/2n:1/3n=6:3:2,故A项正确。
本题难度:一般
2、选择题 0.5LAlCl3溶液中含Cl—9.03×1023个,则溶液物质的量浓度是?(?)
A.0.1mol/L
B.1mol/L
C.3mol/L
D.1.5mol/L
参考答案:C
本题解析:略
本题难度:简单
3、选择题 一种新的储氢方法,其原理是NaHCO3+ H2 HCOONa+ H2O。下列叙述正确的是
HCOONa+ H2O。下列叙述正确的是
A.储氢、释氢的过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中NaHCO3被氧化
D.释氢过程中每消耗0.1molH2O放出2.24L的H2
参考答案:B
本题解析:A、根据储氢释氢的反应原理NaHCO3+H2 ?HCOONa+H2O可知,储氢、释氢过程都是化学变化,化学变化中一定伴随能量变化,故A错误;B、NaHCO3晶体是离子晶体,由Na+与HCO3-构成,HCO3-中含有共价键;HCOONa晶体是离子晶体,由Na+与HCOO-构成,HCOO-中含有共价键,故B正确;C、储氢过程中C元素的化合价由+4降低为+2,NaHCO3被还原,故C错误;D、根据储氢释氢的反应原理NaHCO3+H2
?HCOONa+H2O可知,储氢、释氢过程都是化学变化,化学变化中一定伴随能量变化,故A错误;B、NaHCO3晶体是离子晶体,由Na+与HCO3-构成,HCO3-中含有共价键;HCOONa晶体是离子晶体,由Na+与HCOO-构成,HCOO-中含有共价键,故B正确;C、储氢过程中C元素的化合价由+4降低为+2,NaHCO3被还原,故C错误;D、根据储氢释氢的反应原理NaHCO3+H2 ?HCOONa+H2O可知,释氢过程中,每消耗0.1molH2O放出0.1mol的H2,但由于该题未指明在标准状况下,所以0.1mol的H2不一定为2.24L,故D错误,答案选B。
?HCOONa+H2O可知,释氢过程中,每消耗0.1molH2O放出0.1mol的H2,但由于该题未指明在标准状况下,所以0.1mol的H2不一定为2.24L,故D错误,答案选B。
本题难度:一般
4、填空题 (8分)在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸, 所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
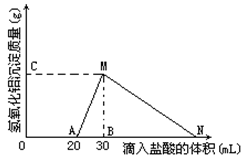
问:
(1)此溶液中同时含有____mol___?离子;
(2)用离子方程式表示MN段发生的反应是?
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)=?
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为?mL
参考答案:(1)0.02mol;OH-? (2)Al(OH)3+3H+=Al3++3H2O
(3)1mol ?(4)60ml
本题解析::(1)由图可知,滴加盐酸开始不产生沉淀,故溶液中还含有OH-,开始加入的20mL盐酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)=n(H+)=0.02L×1mol/L=0.02mol,
故答案为:0.02;OH-;
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)由图可知,从20mL~40mL发生的反应为AlO2-+H++H2O═Al(OH)3↓,该阶段消耗的盐酸体积为40mL-20mL=20mL,由方程式可知溶液中n(AlO2-)=n(H+)=0.01L×1mol/L=0.01mol,故c(AlO2-)=0.01mol/.0.01L=1mol/L,
故答案为:1;
(4)由图可知,加盐酸到点N处,氢氧化铝恰好完全溶解,此时溶液中阴离子为Cl-,根据电荷守恒可知n(Cl-)=n(AlO2-)+n(OH-)=0.01mol+0.02mol=0.03mol,故此阶段消耗的盐酸的体积为0.03mol/1(mol/L) =0.03L=30mL,故N点滴入的HCl溶液体积共为30mL+30mL=60mL,
故答案为:60。
点评:本题考查铝及其化合物的性质、有关图象的化学计算等,难度中等,清楚各阶段发生的反应是解题的关键,注意元素化合物知识的掌握。
本题难度:一般
5、计算题 将36 mL KBr和KI的混合溶液分为两等份。向其中一份通入足量的Cl2,完全反应后蒸发溶液至干,灼烧所得物质,得6.1 g固体残留物。测得另一份混合液中I-的浓度为0.086 mol·L-1。试判断并计算:
(1)固体残留物中含有什么物质?
(2)原溶液中含有KBr的质量为多少?
(3)反应完全时消耗Cl2的体积(标准状况)是多少?
参考答案:(1)KCl?(2)15.9 g?(3)0.92 L
本题解析:(1)固体残留物是KCl。因为通入足量的Cl2时,发生的反应有:2KI+Cl2 2KCl+I2,2KBr+Cl2
2KCl+I2,2KBr+Cl2 2KCl+Br2。在蒸干并灼烧的过程中,I2会升华,Br2会挥发,H2O会汽化。
2KCl+Br2。在蒸干并灼烧的过程中,I2会升华,Br2会挥发,H2O会汽化。
(2)欲计算原溶液中KBr的含量,可通过已知混合溶液中I-的浓度,据反应首先计算由KI生成KCl的质量,再由残留物的总质量与KI生成KCl质量的差,进一步计算出在一份溶液中含KBr的质量。与此同时,也可求得通入Cl2的体积。
因c(KI)=c(I-)=0.086 mol·L-1,则在一份溶液中含KI物质的量即为0.086 mol·L-1×0.018 L=0.015 mol。
由2KI? ~? Cl2?~? 2KCl
2 mol? 22.4 L? 149 g
0.015 mol?x?y
解得:x=0.168? L,y=1.12 g
因在6.1 g固体残留物中KBr生成KCl的质量为6.1 g-1.12 g=4.98 g
由2KBr? ~? Cl2? ~? 2KCl
238 g? 22.4 L? 149 g
x′? y′? 4.98 g
解得:x′=7.95 g,y′=0.75 L
故原混合溶液中含KBr的质量为7.95 g×2=15.9 g。
(3)在一份混合溶液中消耗Cl2的体积(标准状况)为0.168 L+0.75 L=0.92 L。
本题难度:简单