微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列气体实验室制备时,可以用相同发生装置的是?
A.O2 HCl
B.Cl2 H2
C.HCl Cl2
D.CO2 HCl
2、填空题 (12分)过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产

根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为?。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替??
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是?。
A.适当加热? B.加压? C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是?。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是?。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为?。
3、实验题 (13分)氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是?。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
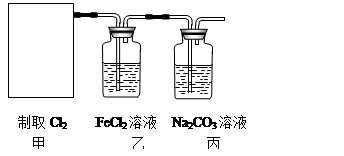
①在该实验中,甲部分的装置是?(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是?。证明FeCl2与Cl2发生了氧化还原反应的实验方法是?。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是?。
④该实验存在明显的缺陷,改进的方法是?。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为?。
4、选择题 当用碱滴定酸时,下列操作中可能使测定结果(酸的浓度)偏低的是
A.滴定后读取标准液体积时仰视
B.锥形瓶用蒸馏水洗后,未干燥
C.碱式滴定管用蒸馏水洗后,未用标准液润洗
D.滴定至溶液呈浅红色后,未等到半分钟立即开始读数
5、选择题 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
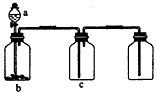
[? ]
气体
a
b
c
A.
NO2
浓硝酸
?铜片
NaOH溶液
B.
SO2
浓硝酸
Cu
酸性KMnO4溶液
C.
NH3
?浓氨水
生石灰
碱石灰
D.
CO2
?稀盐酸
CaCO3
?浓硫酸