微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为?。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为?(用元素符号表示)。
(3)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。
①[B(OH)4]-中B的原子杂化类型为???;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为???。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得右图所示的金刚砂(SiC)结构;若在晶体硅所有Si—Si键中插入O原子即得SiO2晶体。
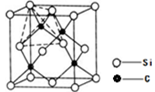
①在SiC中,每个C原子周围最近的C原子数目为???;
②判断a. SiO2,b.干冰,c.冰3种晶体的熔点从小到大的顺序是?(填序号)。
参考答案:(12分)
(1)3d10 (2分)?(2)Br>As>Se (2分)? (3)①SP3(2分)
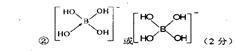
(4)①12(2分)②b<c<a(2分)
本题解析:
(1)亚铜离子是由铜原子失去了一个电子得到的,所以有28个电子,所以为3d10;
(2)由于AS的外围电子排布式为4S24P3每个轨道电子处于半充满状态,能量比较低,比较稳定,失去电子较困难。
(3)①根据价层电子互斥理论,[B(OH)4]-中B中价电子数为(3+4+1)/2=4,所以应该是SP3杂化;
②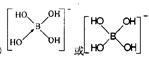
(4)①在SiC中,每个SI和周围的四个原子以共价键结合,其结构和金刚石相同。观察其结构图可知应该为12;②b.干冰c.冰是分子晶体,但冰中存在氢键,所以晶体的熔点从小到大的顺序是b<c<a。
本题难度:困难
2、选择题 既有离子键又有共价键的化合物是
[? ]
A.Na2O
B.MgCl2
C.NaOH
D.H2O
参考答案:C
本题解析:
本题难度:简单
3、填空题 现有1——20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:
元素
| 物质性质或微粒结构
|
A
| M层上有2对成对电子
|
B
| B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂
|
C
| 常温下单质为双原子分子,其氢化物水溶液呈碱性
|
D
| 元素最高正价是+7价
|
?
(1)元素A的原子最外层共有______种不同运动状态的电子,有___种能量不同的电子。B的
离子与D的离子相互组合形成的干燥剂的化学式是_________。
(2)元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式(用元素符号表示)
_________________
(3)元素A与元素D相比,非金属性较强的是_____(用元素符号表示),下列表述中能证明
这一事实的是_______
A.常温下A的单质和D的单质状态不同?
B.A的氢化物比D的氢化物稳定
C.一定条件下D能从A的氢化物水溶液中置换出A单质
D.HD的酸性比HA酸性强
(4)C的氢化物固态时属于______晶体,该氢化物与A的最高价氧化物水化物反应的化学方程式是__________________________________________________。
参考答案:(本题共8分,每空1分)
(1)6,2,CaCl2?
(2)
(3)Cl,C
(4)分子,2NH3+H2SO4→(NH4)2SO4
本题解析:M层上有2对成对电子可推出A原子3P轨道分布了4个电子,为S;根据C的氢化物水溶液呈碱性可知C为N;1—20号元素元素最高正价是+7价只有Cl,所以D为Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,可推出D为Ca元素。
(1)S原子最外层为6个电子,既有6种电子运动状态,分布在3S、3P轨道上,有2种能量不同的电子,Cl?与Ca2+形成的干燥剂为CaCl2。
(2)N元素与氢元素形成带一个单位正电荷的离子为NH4+。
(3)根据元素周期律和元素周期表,Cl的非金属性大于S;一定条件下Cl2能从H2S水溶液中置换出S单质,说明Cl原子的得电子能力大于S原子,Cl元素的非金属性大于S元素。
(4)C的氢化物为NH3,固态时属于分子晶体,A的最高价氧化物水化物为H2SO4,二者反应生成(NH4)2SO4。
本题难度:一般
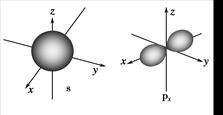
4、填空题 如图是s能级和p能级的原子轨道图,试回答问题:
 ?
?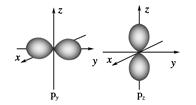
(1)s电子的原子轨道呈________形,每个s能级有________个原子轨道;p电子的原子轨道呈________形,每个p能级有________个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是______电子,其电子云在空间有______________方向;元素X的名称是______,它的氢化物的电子式是________________________________________________________________________。
参考答案:(1) 球 1 纺锤 3? (2) 2p 三个互相垂直的伸展 氮?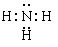
本题解析:(1)s电子的原子轨道呈球形,每个s能级有1个原子轨道;p电子的原子轨道呈纺锤形,每个p能级有3个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,则n=2,所以该元素的原子序数是7,是氮元素。其中原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向。其氢化物是氨气,含有极性键,其电子式是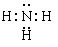 。
。
点评:该题是常识性知识的考查,难度不大。熟练记住核外电子的排布以及常见电子云的形成,并能灵活运用即可。
本题难度:一般
5、选择题 下列说法中错误的是(?)
A.若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同
D.短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b
参考答案:C
本题解析:A项正确;B项C2H5OH分子间存在氢键,沸点高,正确;C项CO2克服分子间作用力,SiO2晶体是原子晶体,克服的是共价键;D项aXm+和bYn-具有相同的电子层结构,说明X在Y的下一周期,则a>b,正确。
点评:分子晶体的熔沸点决定于相对分子质量,但是有氢键的熔沸点要大很多,属于简单题。
本题难度:一般