微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将含有0.4molNaCl和0.5mol?Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol?Cu,则在另一个电极上析出的气体(标准状况下)的体积是( )
A.4.48L
B.5.6L
C.6.72L
D.11.2L
参考答案:将含有0.4mol?NaCl和0.5mol?Cu(N03)2的水溶液1L,用惰性电极电解,溶液中的阳离子有Cu2+、H+、Na+;移向阴极,发生的电极反应为:Cu2++2e-=Cu
阴离子Cl-、OH-、NO3-;移向阳极;电极反应为:2Cl--2e-=Cl2↑,0.3molCu生成转移电子为0.6mol;溶液中氯离子物质的量为0.4mol,全部反应失去电子物质的量为0.4mol,生成氯气为0.2mol,还有0.2mol电子是氢氧根离子失去发生电极反应为:4OH--4e-=2H2O+O2↑生成氧气为0.05mol,所以共生成气体标准状况下生成气体体积为(0.05mol+0.2mol)×22.4L/mol=5.6L;
故选B.
本题解析:
本题难度:简单
2、填空题 (14分)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:

①C(s) + H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) ===" CO(g)" + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min)
浓度(mol·L-1)
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.68
| 0.50
| 0.50
| 0.60
| 0.60
|
N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
①10~20min内,N2的平均反应速率v(N2)= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
参考答案:(1)C(s) + 2H2O(g) = CO2(g) + 2H2(g)
本题解析:
本题难度:困难
3、选择题 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用如图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体VmL,下列说法正确的是
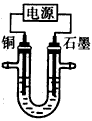
[ ? ]
A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是
参考答案:C
本题解析:
本题难度:一般
4、选择题 按规定在食盐中添加一定量的碘化钾(KIO3)即成为可以为人体补充碘元素的“加碘食盐”.KIO3可用在一定温度下电解KI水溶液的方法制得.以下关于这一生产得叙述正确的是( )
A.KIO3在阳极产生,阴极产物为H2
B.可以用不锈钢棒作两个电极的材料
C.产生IO3-离子的电极周围溶液pH增大
D.溶液中阳离子向阳极移动
参考答案:A、电解KI水溶液时,阳极反应为:I--6e-+6OH-=I03-+3H2O,阴极反应为:2H+-2e-=H2↑,故A正确;
B、电解时应用惰性电极做电极材料,否则在阳极上放电的不是I-离子,导致电解得不到所需物质,故B错误;
C、根据阳极反应:I--6e-+6OH-=I03-+3H2O,可知阳极反应消耗OH-离子,阳极区的PH减小,故C错误;
D、电解池工作时,阴离子向阳极移动,阳离子向阴极移动,故D错误.
故选A.
本题解析:
本题难度:一般
5、选择题 如图所示,下列叙述正确的是

[? ]
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触变红
参考答案:A
本题解析:
本题难度:一般