微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铜和浓硫酸发生反应,下列说法中正确的是(气体体积在标准状况下测定)( )
A.若提供0.2mol硫酸,铜不足量,则可制得SO2气体2.24L
B.若提供0.2mol硫酸,铜足量,则可制得SO2气体2.24L
C.若有0.2mol硫酸参与反应,则可制得SO2气体2.24L
D.若有0.2mol硫酸被还原,则可制得SO2气体2.24L
参考答案:根据化学方程式Cu+2H2SO4(浓)═CuSO4 +SO2↑+2H2O可知,
A、若提供0.2mol硫酸,随着反应的进行,浓硫酸会变稀,稀硫酸与铜不反应,尽管铜不足量,制得SO2气体仍小于2.24L,故A错误;
B、若提供0.2mol硫酸,铜足量,随着反应的进行,浓硫酸会变稀,稀硫酸与铜不反应,则制得SO2气体小于2.24L,故B错误;
C、若有0.2mol硫酸参与反应,则可制得SO2气体2.24L,故C正确;
D、若有0.2mol硫酸被还原,则可制得SO2气体4.48L,故D错误;
故选C.
本题解析:
本题难度:简单
2、填空题 为了确定CH3COOH ,?OH及H2CO3的酸性强弱,有人设计一个简单的一次性完成实验的装置图如右所示:(每空2分共8分)
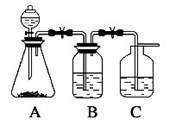
(1)若锥形瓶中装有一易溶于水的正盐固体,则A中发生反应的离子方程式为?
(2)装置B中盛放的试剂是??,它的作用是 ?
(3)实验中观察到C中出现的主要现象是?
?.
参考答案:(1)2CH3COOH+CO2-3=2CH3COO--+CO2↑+H2O
(2)饱和NaHCO3溶液 除去CO2中混有的CH3COOH
 (3)C中溶液变浑浊
(3)C中溶液变浑浊
本题解析:酸性: CH3COOH>H2CO3>?OH>HCO3-;用2CH3COOH+Na2CO3=2CH3COONa+ CO2↑+H2O 来证明CH3COOH强于H2CO3;用CO2+H2O+?ONa →? OH+ NaHCO3,来证明H2CO3酸性大于? OH,中间为了避免CH3COOH挥发来对实验造成干扰,用饱和NaHCO3溶液 除去CO2中混有的CH3COOH。
本题难度:简单
3、选择题 已知亚硫酸盐、金属硫化物等易被空气氧化.下列试剂长期暴露在空气中不会发生化学变化的是( )
A.Na2SO3溶液
B.氢硫酸
C.浓H2SO4
D.固体氢氧化钠
参考答案:A.Na2SO3溶液易被氧化生成硫酸钠,故A不选;
B.氢硫酸易被空气中氧气氧化生成硫,故B不选;
C.浓硫酸具有吸水性,在空气中露置,浓度降低,但化学性质没有变化,故C选;
D.氢氧化钠为强碱,易与空气中二氧化碳反应,故D不选.
故选C.
本题解析:
本题难度:简单
4、选择题 在硫酸的工业制法中,下列生产操作与说明的原因二者都正确的是( )
A.硫铁矿燃烧前需将矿粒粉碎,这样易于向沸腾炉中投料
B.炉气进入接触室之前需要净化、干燥,因为炉气中的杂质易与SO2反应
C.SO2氧化为SO3时需使用催化剂,这样可提高SO2的转化率
D.接触室的反应温度控制在400~500℃,因为在该温度范围内催化剂的活性较高
参考答案:D
本题解析:
本题难度:一般
5、填空题 (12分)实验室用下图装置制取乙酸乙酯。
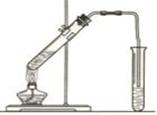
(1)加热前在大试管中加入几粒碎瓷片的作用是?,
(2)导气管不能插入饱和Na2CO3溶液液面以下是为了?,
(3)实验室制取乙酸乙酯的化学反应方程式为:?。
(4)饱和Na2CO3溶液的作用是?,?,?。
参考答案:(1)防爆沸;(2)防止倒吸;(3)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(4)中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度
本题解析:⑴加热前在大试管中加入几粒碎瓷片的作用是为了防止爆沸。⑵导气管不能插入饱和Na2CO3溶液液面以下是为了防止倒吸现象的发生;(3)实验室是以乙酸与乙醇在浓硫酸作用下加热,发生酯化反应而产生的。制取乙酸乙酯的化学反应方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O。(4)饱和Na2CO3溶液的作用有三个,它们是:中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度。
本题难度:一般