微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 密度为0.91 g·cm-3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度
A.等于12.5%
B.大于12.5%
C.小于12.5%
D.无法确定
参考答案:C
本题解析:
【错解分析】错选 ①A,②B。出现①误区,是由于当假设加入与氨水等质量的水,进行稀释后,可推导出溶液的质量增加一倍,氨水的质量百分比浓度为12.5%,于是就匆匆忙忙选取①为答案。完全违背了原来“巧解”的意愿,造成了失误。由此可见,稍有疏忽,就会半途而废,望大家引以为戒。出现②误区,是由于思维定势的干扰。
【正解】本题的突破口在“该氨水用等体积的水稀释”。我们可以假设加入与氨水等质量的水,进行稀释,这时溶液的质量增加一倍,所以氨水的质量分数应该变为原来的一半,即为12.5%。但题目所给的是加入与氨水等体积的水,由于水的密度(1 g·cm-3)大于氨水的密度(0.91 g·cm-3),所以这时溶液的总质量大于原溶液质量的两倍,则所得溶液的质量百分比浓度(即质量分数)应该小于12.5%。
本题的一般解法是根据质量百分比浓度(即质量分数)的概念,按公式求解。即

不必大乘大除,也可估计出结果小于12.5%。
本题难度:一般
2、选择题 下列反应中,H2O作还原剂的是
A.2Na2O2+2H2O =" 4NaOH" + O2↑
B.2F2+2H2O =" 4HF" + O2↑
C.3NO2 + H2O =" NO" + 2HNO3
D.3Fe+4H2O(g)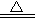 4H2+Fe3O4
4H2+Fe3O4
参考答案:B
本题解析:A.在该反应中Na2O2既作氧化剂,又作还原剂,而水既不是氧化剂,也不是还原剂,错误;B.H2O作还原剂,正确;C.在反应3NO2 + H2O =" NO" + 2HNO3水既不是氧化剂,也不是还原剂,错误;D.在反应3Fe+4H2O(g) 4H2+Fe3O4中水是氧化剂,错误。
4H2+Fe3O4中水是氧化剂,错误。
本题难度:一般
3、选择题 2010年10月1日18时59分57秒,“嫦娥二号”卫星发射升空。嫦娥二号用的火箭的一子级和二子级使用偏二甲肼和N2O4作为推进剂,反应式为:(CH3)2NNH2+2N2O4=2CO2+4H2O+3N2 ,三子级则使用效能更高的液氢(H2)和液氧(O2)。下列说法正确的
A.N2O4在反应中被氧化
B.反应中1molN2O4得到4mole-
C.(CH3)2NNH2具有还原性
D.液氢与液氧的反应中转移的电子数为2NA
参考答案:C
本题解析:略
本题难度:一般
4、计算题 (9分)1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
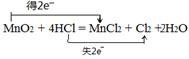
(1)请用双线桥表示该反应电子转移方向和总数 _ __。MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)计算生成Cl2的体积(折算成标准状况)为__ ____L(写计算过程,否则不得分)。
(3)计算稀释后溶液中Cl—的物质的量浓度为__ ___ mol·L—1(写计算过程,否则不得分)。
参考答案:20.(9分)
(1) (2分) (2)4.48L (3分) (3)4 mol/L(4分)
(2分) (2)4.48L (3分) (3)4 mol/L(4分)
本题解析:(1)双线桥法表示电子转移, ;
;
(2)17.4gMnO2的物质的量为0.2mol,200g 36.5%的浓盐酸中HCl的物质的量为2mol,Cl-为2moL
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 反应掉2Cl-
MnCl2+Cl2↑+2H2O 反应掉2Cl-
22.4 2
0.2 V n V=4.48L n=0.4moL
(3)稀释后溶液中Cl—的物质的量浓度为(2-0.4)/0.4=4 mol/L。
考点:考查氧化还原反应电子转移的表示方法,根据化学方程式计算。
本题难度:一般
5、简答题 为了测定小苏打样品的变质情况,取13.7g固体样品加到100mL盐酸溶液中,恰好完全反应.产生的气体体积如图所示.请计算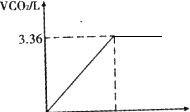
(1)所用盐酸的物质的量浓度.
(2)所取小苏打样品纯度.
参考答案:n(CO2)=3.36L22.4L/mol=0.15mol,
设混合物中含有xmolNa2CO3,ymolNaHCO3,
则
本题解析:
本题难度:一般