微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。 (1)T业上用黄铁矿(FeS2)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率(已知SO3。熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)。
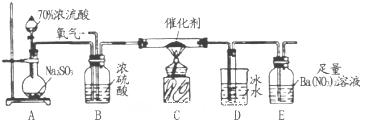
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某兴趣小组欲在绿色环保的条件下探究SO2的性质,设计如下图实验装置。
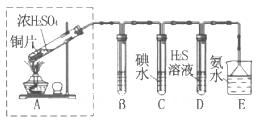
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为_______;
C中反应的离子方程式为______ ;D中的实验现象为______ ;E装置的作用是______。
参考答案:(1)S、Fe ?11.2
(2)①打分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。②使残留在装置中的二氧化硫和三氧化硫被充分吸收。③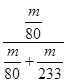 ×100﹪
×100﹪
(3)品红溶液? SO2+I2+2H2O=SO42-+2I-+4H+?试管中有淡黄色沉淀生成。 ?吸收尾气,防止倒吸。
本题解析:在反应4FeS2+11O2 8SO2+2Fe2O3中FeS2中的Fe为+2价,反应后变为Fe2O3的+3价,化合价升高,失去电子,被氧化;FeS2中的S为-1价,反应后变为SO2的+4价,化合价升高,失去电子,被氧化. 该反应中被氧化的元素是Fe、S。在该反应中每产生8mol的SO2转移电子44mol. 。现在转移2. 75mol电子,所以产生SO2在标准状况下的体积为(2. 75mol÷44mol)×8mol×22.4L/mol="11.2L." (2) ①使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是打分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是使残留在装置中的二氧化硫和三氧化硫被充分吸收。③装置D中增加的质量是SO3的质量,E中的沉淀为BaSO4。则此条件下二氧化硫的转化率是
8SO2+2Fe2O3中FeS2中的Fe为+2价,反应后变为Fe2O3的+3价,化合价升高,失去电子,被氧化;FeS2中的S为-1价,反应后变为SO2的+4价,化合价升高,失去电子,被氧化. 该反应中被氧化的元素是Fe、S。在该反应中每产生8mol的SO2转移电子44mol. 。现在转移2. 75mol电子,所以产生SO2在标准状况下的体积为(2. 75mol÷44mol)×8mol×22.4L/mol="11.2L." (2) ①使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是打分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是使残留在装置中的二氧化硫和三氧化硫被充分吸收。③装置D中增加的质量是SO3的质量,E中的沉淀为BaSO4。则此条件下二氧化硫的转化率是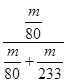 ×100﹪。(3) B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液,C中反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+,D中发生的反应为:SO2+2H2S=3S↓+2H2O。产生的S是不溶于水的淡黄色沉淀。故D的实验现象为试管中有淡黄色沉淀生成。SO2是有害的气体,容易导致大气污染,是大气污染物,E装置的作用是既能吸收尾气,也能防止倒吸现象的发生。2的制备方法和性质的知识。
×100﹪。(3) B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液,C中反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+,D中发生的反应为:SO2+2H2S=3S↓+2H2O。产生的S是不溶于水的淡黄色沉淀。故D的实验现象为试管中有淡黄色沉淀生成。SO2是有害的气体,容易导致大气污染,是大气污染物,E装置的作用是既能吸收尾气,也能防止倒吸现象的发生。2的制备方法和性质的知识。
本题难度:一般
2、选择题 下列物质中,能使品红溶液褪色的是
A.甲烷
B.盐酸
C.二氧化硫
D.二氧化碳
参考答案:C
本题解析:在所给的物质中,只有SO2具有漂白性,能使品红溶液褪色,其余选项不可以,因此正确的答案选C。2的漂白性
点评:该题是基础性试题的考查,主要是对教材基础知识的巩固和训练。该题是识记性知识的检验,难度不大,记住常见的漂白剂以及漂白原理即可。
本题难度:简单
3、实验题 无水氯化铝是一种重要的化工原料,利用明矾石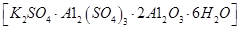 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下:
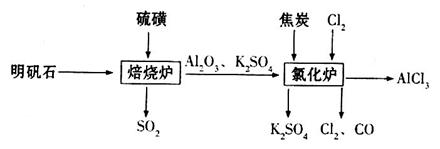
(1)验证焙烧炉产生的气体含有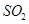 的方法是________________________________。
的方法是________________________________。
(2)吸收焙烧炉中产生的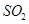 ,下列装置合理的是________(填代号)。
,下列装置合理的是________(填代号)。
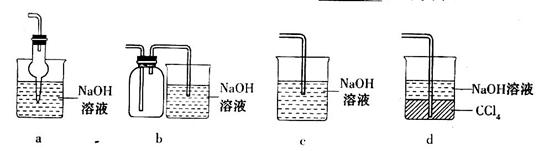
(3)氯化炉中发生反应的化学方程式为_________________________________________。
(4)生产氯化铝的过程中产生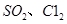 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
__________________________________________________________________________。
仪器自选;可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液?②氯化亚铁溶液?③硫氰化钾溶液?④品红溶液
(5)某学习小组设计用如下装置验证二氧化硫的某些化学性质。
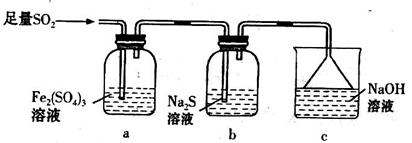
①能说明二氧化硫具有氧化性的实验现象为_____________________________________。
②写出a瓶中发生反应的离子方程式___________________________________________。
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀
上述实验中能证明二氧化硫具有还原性的是________(填实验代号)。
参考答案:
(1)将气体通入品红溶液,若品红褪色,加热后又变红,证明有SO2。
(2)ad
(3)3C+Al2O3+3Cl2  3CO+2 AlCl3
3CO+2 AlCl3
(4)取所得的溶液少许置于试管中,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则二者未完全反应。
(5)①b中出现淡黄色浑浊。
②2 Fe3++ SO2+2 H2O = SO42-+2 Fe2++4 H+
③Ⅰ和Ⅱ
本题解析:
(1)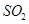 的检验试剂为品红,可以形成不稳定的有机化合物,变为无色,加热时有恢复。
的检验试剂为品红,可以形成不稳定的有机化合物,变为无色,加热时有恢复。
(2)尾气的吸收装置的考查,需要有防倒吸装置,b装置的防倒吸装置安全瓶的导管错误。c无防倒吸装置。
(3)见答案。
(4)取所得溶液少许置于试管中,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应。Cl2和SO2均可使品红褪色,原理不同。
(5)①b装置中有黄色物质析出,SO2将S2-氧化成S。
②Fe3+将SO2氧化成硫酸。
③实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色,说明有Fe2+存在。证明Fe3+将SO2氧化成硫酸,Fe3+被SO2还原为Fe2+。
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去,SO2将KMnO4还原。
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀,说明有硫酸根存在。
本题难度:一般
4、选择题 某元素A的气态氢化物受热分解后,能生成H2和一种固体物质,已知相同条件下分解后气体的体积为分解前气体体积的2倍,又知分解前后气体式量比为16:1,则可知A的相对原子量为
A.12
B.15
C.28
D.32
参考答案:C
本题解析:略
本题难度:简单
5、实验题 标准状况下,将1L可能含有N2,H2,CO,NH3,NO2,H2S杂质的无色SO2气体,依次通过如下图所示的装置。(各容器中液体均为足量)

其变化情况是:①气体通过A瓶,浓H2SO4无明显变化,气体体积无变化;②气体通过B瓶,饱和Na2CO3溶液质量增加0.5g,气体体积无变化;③气体通过C瓶后,再通过D管,灼热的CuO中有红色物质生成。冷却后,气体体积变为888ml(标准状况);④将上述气体通过E后,再通入F中,澄清石灰水变浑浊,同时增重1.54g;⑤气体经过干燥管P后,在量筒H中,收集到水104ml。根据以上实验回答:
(1)混合气体中SO2的体积分数为______________。
(2)混合气体中含有的杂质为______________。
(3)混合气体中是否含有H2、CO杂质;若有,指出其体积;若无,说明理由。
a.H2:____________________________________________________________________;
b.CO: ____________________________________________________________________。
参考答案:(1)56%;(2)N2,H2,CO;(3)H2∶112mL;(4)CO∶224mL
本题解析:①气体通过浓H2SO4,体积无变化,说明无NH3和H2S(H2S与浓H2SO4发生氧化还原反应)。
②气体通过饱和Na2CO3溶液质量增加0.5g,发生了反应:
SO2+Na2CO3=Na2SO3+CO2 Δm
22.4L ∶ 44g (64-44)g
V(SO2) ∶ m(CO2) 0.5g
V(SO2)=0.56L? m(CO2)=1.1g
φ(SO2)=0.56L/1L×100%=56%
③通过灼热的CuO有红色物质生成,说明有还原性气体H2或CO或两者皆有。
④通入澄清石灰水变浑浊,说明有CO2(由两部分 组成),且为1.54g,则③中的还原性气体必含CO:
CO?~ CO2?~? Ca(OH)2
22.4L 4g
V(CO) (1.54g-1.1g)
V(CO)=22.4L×0.44g/44g=0.224L=224mL
⑤最后得到的气体只能是N2,且V(N2)=V(H2O)=104mL,S则V(H2)=1000ml-888mL=112mL。
本题难度:简单