微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是
A.可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸
B.当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法分离或洗涤
C.在硫酸亚铁铵制备实验中,用少量酒精洗去晶体表面附着的水分;在阿司匹林的制备实验中用冷水洗涤阿司匹林
D.把等物质的量浓度的硫酸铵和硫酸亚铁混合,搅拌,小火加热,在蒸发皿中蒸发至有大量晶体析出,即可得硫酸亚铁铵晶体
参考答案:D
本题解析:水杨酸中含有酚羟基,可用氯化铁溶液检验,A正确。BC都是正确的。D不正确,应该是当有晶膜出现时,即停止加热。答案选D。
本题难度:一般
2、选择题 下列有关实验原理或实验操作正确的是(?)
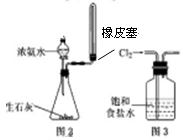
A.用水湿润pH试纸测量某溶液的pH
B.用量筒量取20mol ?L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol·L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置出去Cl2中的少量HCl
参考答案:D
本题解析:pH试纸测定溶液pH值时,不能润湿,A错误。配制成0.1000 mol?L-1H2SO4溶液应该用容量瓶,且稀释浓硫酸时,不能把水倒入浓硫酸中,B不正确。C不正确,收集氨气的试管不能用玻璃塞塞住,而要塞一团棉花。氯化氢极易溶于水,可用饱和食盐水除去氯气中的氯化氢,所以正确的答案是D。
本题难度:一般
3、实验题 (10分)某校的研究性学习小组进行测定混合物各组分质量比的研究,甲、乙、丙三位同学各设计了一种实验方案如下表所示:(混合物的质量事先已称量好)
实验
序号
| 混合物
| 第一步:加入适量水,充分溶解
| 第二步:加入或通入的试剂
| 第三步:过滤后洗涤干燥所得固体
| 第四步:蒸发滤液得到晶体
| 第五步:称量,记录数据计算质量比
|
甲
| BaCl2
NaCl
| 澄清溶液
| 过量CO2
| 无固体
| 晶体
| 称量所得
晶体
|
乙
| CaCl2
NaCl
| 澄清溶液
| 过量饱和
Na2CO3溶液
| CaCO3
| NaCl
| 称量蒸发
所得晶体
|
丙
| Na2SO4
MgSO4
| 澄清溶液
| 过量NaOH
溶液
| ?
| ?
| ?
|
试回答下列问题:
(1)你认为甲同学设计的实验步骤中,根据称量所得到的数据,?(填“能”或“不能”)准确计算出混合物中各组分的质量比。
(2)经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误。其原因是什么??。
(3)丙同学对实验进行了较合理的设计,将其后三步相应内容仿照前面的形式填入对应的空格内。
参考答案:(10分,每空(项)2分)(1)不能?
(2)第二步加入碳酸钠溶液是过量的,最后所得NaCl晶体中有碳酸钠存在
(3)
丙
?
?
?
Mg(OH)2
NaOH? Na2SO4
称量过滤所得Mg(OH)2固体
本题解析:(1)由于氯化钡和CO2是不能反应的,所以最终得到的晶体仍然是氯化钡和氯化钠,所以不能电池混合物中各物质的质量比。
(2)由于第二步加入碳酸钠溶液是过量的,所以最后所得NaCl晶体中有碳酸钠存在。
(3)由于氢氧化钠溶液能和硫酸镁反应生成氢氧化镁白色沉淀,所以过滤后所得的晶体是氢氧化镁。而滤液中含有硫酸钠和过量的氢氧化钠,最后通过称量氢氧化镁的质量。即可得出物质中各组成的质量比,即
丙
?
?
?
Mg(OH)2
NaOH? Na2SO4
称量过滤所得Mg(OH)2固体
本题难度:一般
4、选择题 下列物质与常用危险化学品的类别不对应的是
A. 、
、 ——腐蚀品
——腐蚀品
B. ?——易燃液体
?——易燃液体
C.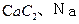 ——遇湿易燃物品
——遇湿易燃物品
D.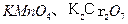 ——氧化剂
——氧化剂
参考答案:B
本题解析:略
本题难度:一般
5、选择题 下列原理或操作不正确的是
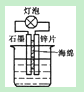
A.在如图装置的稀硫酸中加入适量重铬酸钾或适量6%的H2O2溶液,可以使灯泡亮度增大,持续时间变长
B.在提纯混有少量NaCl的KNO3时,常先将混合物在较高温度下溶于水形成浓溶液,再经过冷却结晶、过滤、洗涤、干燥,获得KNO3晶体
C.制摩尔盐时用酒精洗涤产品,用干净的滤纸吸干;而在制阿司匹林粗品时用冷水洗涤产品,在空气中风干
D.纸层析法分离微量成份时均需有以下流程:装置制作—→点层析试样—→配制展开剂—→层析操作—→显色反应。
参考答案:D
本题解析:A、加入适量重铬酸钾或适量6%的H2O2溶液增强溶液的氧化性,降低了电极的极化作用,可以
使灯泡亮度增大,持续时间变长正确;B、NaCl溶解度受温度影响较小,而KNO3溶解度受温度影响较
大,所以可以通过降温结晶的方法除去NaCl,正确;C、摩尔盐溶于水中,故用酒精洗涤减少溶解损失,
正确;D、若是有色微粒就不需要显色反应这一步骤,错误。
本题难度:简单