微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把100mL6mol/LH2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可以在反应物中加入适量的
A.Na2CO3固体
B.NaOH固体
C.硫酸钾溶液
D.硫酸钠固体
参考答案:C
本题解析:A错,加入碳酸钠能与硫酸反应,使生成的氢气的总量减少;B错,加入氢氧化钠会与硫酸反应使生成的氢气总量减少;C正确,加入硫酸钾溶液,硫酸钾与硫酸不反应,而溶液加入相当于稀释,但不减少氢离子的总物质的量;D错,加入硫酸钠固体,不反应速率不变;
本题难度:困难
2、选择题 下列物质所含分子物质的量最多的是
A.4 ℃时2.7 mL水
B.2.8 g CO
C.6.02×1022个HCl分子
D.4.9 g H3PO4
参考答案:A
本题解析:物质所含分子物质的量多少由关系式n=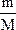 =
=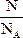 判断。
判断。
2.7 g/18 g·mol-1="0.15" mol? 2.8 g/28 g·mol-1="0.1" mol
6.02×1022/6.02×1023 mol-1="0.1" mol
4.9 g/98 g·mol-1="0.05" mol
本题难度:简单
3、选择题 下列说法正确的是
A.催化剂只能加快化学反应速率
B.光是影响某些化学反应速率的外界条件之一
C.决定化学反应速率的主要因素是浓度
D.不管什么反应,增大浓度,或加热,或加压,都可以加快反应速率
参考答案:B
本题解析:催化剂有正负之分,正催化剂能够加快化学反应速率,负催化剂能够减慢化学反应速率,故A错;光能影响某些反应,例如氯水、浓硝酸及硝酸银的分解,故B正确;决定化学反应速率的主要因素是参加反应物质的性质,所以C错;加压只能加快有气体参加的化学反应的速率,所以D错.
本题难度:一般
4、选择题 根据热化学方程式:S(s)?+?O2(g)=?SO2(g);△H=akJ·mol-1(a=-297.2),分析下列说法中不正确的是
A.S(s)在O2(g)中燃烧的反应是放热反应
B.S(g) + O2(g)= SO2(g);△H=bkJ·mol-1
C.则aD.1mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和
E.16克固体硫在空气中充分燃烧,可放出148.6kJ的热量
参考答案:B
本题解析:硫燃烧是放热反应,说明反应物的总能量高于生成物的总能量,所以A、C正确。根据热化学方程式可知计算,选项D正确。由于气态硫的能量高于固态硫的能量,所以气态硫燃烧放出的热量多余固态硫燃烧放出的能量,但放热越多,△H越小,所以a大于b,选项B不正确,答案选B。
本题难度:一般
5、选择题 在四个不同的容器中,在不同条件下进行合成氨的反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(H2)=0.1 mol/(L·min)
B.v(N2)=0.1 mol/(L·min)
C.v(N2)=0.2 mol/(L·min)
D.v(NH3)=0.3 mol/(L·min)
参考答案:C
本题解析:将不同物质表示的反应速率换算成用同一物质(如NH3)表示的反应速率,再比较速率数值的大小.若以物质NH3为标准,则选项A为v(NH3)=0.067 mol/(L·min),选项B为v(NH3)=0.2 mol/(L·min),选项C为v(NH3)=0.4 mol/(L·min),故生成氨的速率最快的是C.
本题难度:一般