微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L H2O中氧原子的数目大于0.5 NA
B.6.0 g醋酸晶体中含有H+的数目为0.1 NA
C.64gCu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA
D.1 mol Cl-含有的核外电子总数为8 NA
参考答案:A
本题解析:A、标准状况下,11.2LH2O的物质的量肯定大于0.5mol,所以氧原子的数目大于0.5 NA,正确;B、醋酸晶体中不存在H+,错误;C、Cu2S中铜化合价为+1,所以64gCu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数应为NA,错误;D、Cl-含有18个电子,所以1 mol Cl-含有的核外电子总数为18NA,错误,答案选A。
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有( )
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④常温下,0.4 mol SiO2所含的共价键数目为1.6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A.2个
B.3个
C.4个
D.5个
参考答案:A
本题解析:标准状况下,20 g重水(D2O)的物质的量为1 mol,D2O又是10电子微粒,故其含有的电子数为10NA,①正确;0.5 mol Fe2+与足量的H2O2溶液反应,转移0.5NA个电子,故②错误;将2 mol NO和1 mol O2混合后,两者反应生成2 mol NO2,NO2又会发生反应:2NO2 N2O4,故体系中的分子总数小于2NA,③错误;SiO2为正四面体结构,1 mol SiO2所含的共价键数目为4NA,故④正确;⑤中没有告诉溶液体积,无法计算,⑤错误;氯气溶于水后部分与水反应,生成盐酸和次氯酸,量不确定,无法计算,⑥错误;⑦中缺少气体所在温度和压强条件,无法计算,错误。
N2O4,故体系中的分子总数小于2NA,③错误;SiO2为正四面体结构,1 mol SiO2所含的共价键数目为4NA,故④正确;⑤中没有告诉溶液体积,无法计算,⑤错误;氯气溶于水后部分与水反应,生成盐酸和次氯酸,量不确定,无法计算,⑥错误;⑦中缺少气体所在温度和压强条件,无法计算,错误。
本题难度:一般
3、选择题 两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况)。则原混合物中Na2O2和NaHCO3的物质的量之比为
A.3:2
B.2:1
C.8:1
D.2:9
参考答案:CD
本题解析:两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出0.1mol的气体,有二氧化碳气体和氧气;将这些气体通入另一份混合物中,发生反应:2Na2O2+2CO2=2Na2CO3+O2?↑,每消耗2mol二氧化碳气体,气体总体积减少1mol,现在气体减少了0.01mol,则参加反应的二氧化碳气体为0.02mol,生成的氧气为0.08mol,从而算出过氧化钠0.16mol,碳酸氢钠物质的量为0.02mol,则比值为8:1。
本题难度:简单
4、选择题 在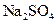 、
、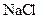 、
、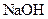 的混合溶液中,含有的
的混合溶液中,含有的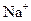 、
、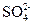 、
、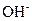 的个数比是8:1:2,则溶液中
的个数比是8:1:2,则溶液中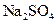 、
、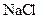 、
、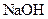 的物质的量之比为(?)
的物质的量之比为(?)
A.1:1:1
B.1:2:4
C.1:3:2
D.1:4:2
参考答案:D
本题解析:略
本题难度:简单
5、选择题 下列溶液中的氯离子浓度与50mL?1mol/L的AlCl3溶液中氯离子浓度相等的是( )
A.150mL1mol/L的NaCl
B.75mL3mol/L的NH4Cl
C.150mL2mol/L的KCl
D.75mL2mol/L的CaCl2
参考答案:50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L.
A、150ml1mol/L的NaCl溶液中Cl-浓度为1mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故A不符合;
B、75mL3mol/L的NH4Cl溶液中Cl-浓度为3mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度相等,故B符合;
C、150mL2mol/L的KCl溶液中Cl-浓度为2mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故C不符合;
D、75ml2mol/L的CaCl2溶液中Cl-浓度为4mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故D不符合.
故选:B.
本题解析:
本题难度:一般