微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关Cl、N、S等非金属元素化合物的说法正确的是
[? ]
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
参考答案:C
本题解析:
本题难度:简单
2、选择题 某有机物和过量钠反应生成气体VaL,另一份等质量的该有机物和碳酸氢钠反应生成VbL气体(同温同压),若Va=Vb,则该有机物可能是()
A.HOCH2CH2COOH
B.CH3COOH
C.HOOC—COOH
D.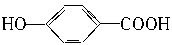
参考答案:AD
本题解析:在有机物中,与NaHCO3反应的是—COOH,1mol—COOH与1molNaHCO3反应生成1molCO2;与Na反应的是—OH(醇、酚、羧酸),2mol—OH与2molNa反应生成1molH2。
本题难度:简单
3、选择题 对金属锌与浓硫酸的反应来说,下列说法不当的是( )
A.若金属锌足量,反应所放出的气体应为混合物
B.反应消耗的锌的物质的量一定等于反应生成的气体的物质的量
C.由于金属铝的活动性强于锌,所以铝与浓硫酸的反应一定比锌与浓硫酸反应剧烈
D.反应中所转移的电子的物质的量一定等于反应生成的气体的物质的量2倍
参考答案:锌和浓硫酸反应方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,
A.锌和浓硫酸反应生成二氧化硫,随着反应的进行,浓硫酸变为稀硫酸时,二者反应生成氢气,所以生成的气体是混合物,故A正确;
B.根据Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑知,消耗锌的物质的量等于生成气体的物质的量,故B正确;
C.常温下,铝和浓硫酸发生钝化现象而阻止进一步反应,故C错误;
D.Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑中,转移电子和生成气体之间的物质的量之比=2:1,故D正确;
故选C.
本题解析:
本题难度:简单
4、简答题 如图装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
(1)检验此装置A、B部分气密性的操作方法和现象是:______-______.
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:______.
(3)装置D中试管口放置的棉花中应浸有一种液体,这液体是______,其作用是:______.
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)______;
a.水 b.浓溴水 c.KMnO4酸性溶液 d.NaHSO3饱和溶液.
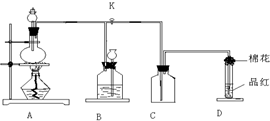
参考答案:(1)将分液漏斗活塞和K关闭,然后加热圆底烧瓶,若装置B中长颈漏斗中的液面上升,说明A、B两处的气密性良好,否则气密性较差,
故答案为:关闭分液漏斗的活塞及K处的活塞,用酒精灯微热烧瓶;若长颈漏斗中的液面上升,说明A、B两处的气密性良好;
(2)烧瓶中铜在加热条件下与浓硫酸反应生成二氧化硫气体、硫酸铜和水,反应的化学方程式为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑;
(3)铜与浓硫酸反应生成的二氧化硫有毒,容易组成大气污染,需要使用碱液溶液吸收多余的二氧化硫,所以该液体可以为氢氧化钠溶液,目的是防止二氧化硫逸出,
故答案为:氢氧化钠溶液;防止二氧化硫逸出;
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体不能导致二氧化硫减少,
a.二氧化硫易溶于水,B中液体不能使用水,故a错误;
b.浓溴水能够氧化二氧化硫,导致二氧化硫减少,故b错误;
c.KMnO4酸性溶液能够氧化二氧化硫,导致二氧化硫减少,故c错误;
d.二氧化硫在饱和亚硫酸钠溶液中溶解度较小,该液体可以为亚硫酸钠饱和溶液,故d正确;
故答案为:d.
本题解析:
本题难度:一般
5、选择题 浓硫酸可用密封的铁或铝质容器贮存,其原因是( )
A.浓硫酸是强酸
B.浓硫酸不跟铁或铝反应
C.浓硫酸使铁或铝表面生成一薄层致密的氧化膜,阻止了内部金属继续跟酸反应
D.浓硫酸是一种油状液体,对铁或铝有保护作用
参考答案:铁、铝与冷的浓硫酸发生钝化,在表面生成一层致密的氧化物膜,起到保护作用,阻碍反应的继续进行,与酸性的强弱以及状态无关,
故选C.
本题解析:
本题难度:简单