微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法错误的是
A.6.02×1023是阿伏加德罗常数的近似值
B.阿伏加德常数个微粒的物质的量是1mol
C.1mol 12C原子的质量为12g
D.硫酸的摩尔质量是98克
参考答案:D
本题解析:摩尔质量的单位是g/mol,所以选项D不正确,其余都是正确的,答案选D。
本题难度:一般
2、选择题 甲、乙两烧杯中各盛有100mL 3mol·L—1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为(?)
A 5.4g ?B 3.6g ?C 2.7g ?D 1.6g
参考答案:A
本题解析:铝粉和盐酸反应方程式2Al+6HCl=2AlCl3+3H2,铝粉和NaOH反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2,根据方程式关系看到消耗等量的铝,需要盐酸的物质的量比NaOH多,但反应中V(甲):V(乙)=1:2,可知盐酸完全参与反应,根据H守恒,可知V(甲)=0.15mol,则V(乙)=0.3mol,对应方程式可知n(Al)=0.2mol,则加入铝粉的质量为5.4克,A正确。
本题难度:一般
3、选择题 FeCl3可用作印刷电路铜板腐蚀剂。为回收废腐蚀液中的铜,必须对废腐蚀液的组成进行分析。某同学取废腐蚀液200 mL,分成甲、乙两等份。向甲溶液中滴加AgNO3溶液至不再有沉淀产生,得到沉淀129.15 g;向乙溶液中加入10 g足量铁粉,充分反应,剩余固体质量4.8 g。计算中忽略溶液体积的变化。
(1)废腐蚀液中Cl-的物质的量浓度是________。
(2)废腐蚀液中Cu2+的物质的量浓度是________。
参考答案:(1)9 mol/L (2)0.5 mol/L
本题解析:(1)n(Cl-)=n(AgCl)=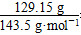 =0.9 mol,c(Cl-)=0.9/0.1=9 mol/L。
=0.9 mol,c(Cl-)=0.9/0.1=9 mol/L。
(2)在FeCl3与Cu反应后的废液中含有FeCl3、FeCl2和CuCl2,向其中加入过量Fe,最终溶液中的溶质是FeCl2,从整个反应过程看,相当于FeCl3与Fe反应生成FeCl2。n(Cu)×64 g/mol+10 g-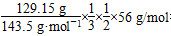 =4.8 g,则n(Cu)=0.05 mol,n(Cu2+)=n(Cu)=0.05 mol。c(Cu2+)=0.05 mol÷0.1 L=0.5 mol/L。
=4.8 g,则n(Cu)=0.05 mol,n(Cu2+)=n(Cu)=0.05 mol。c(Cu2+)=0.05 mol÷0.1 L=0.5 mol/L。
本题难度:一般
4、选择题 .用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.将1mol铁粉加入到一定量的稀硝酸溶液中充分反应,转移的电子数一定是3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1.0 L 1.0 mol·L-1 NaClO溶液中含有ClO-离子的数目为NA
参考答案:C
本题解析:
A.如稀硝酸溶液不足,铁有剩余,转移电子数要小于3NA?;
B.要动用22.4L/mol,必需具备两个条件:1.标况;2.必需为气体;
D.ClO-水解,ClO-离子的数目少于NA。
本题难度:简单
5、选择题 下列叙述正确的是 ( )?
A.1 mol H2O的质量为18g/mol
B.3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:B
本题解析:质量单位是g,A错误;3.01×1023个SO2分子物质的量为0.5mol,质量为32g,B正确;摩尔质量单位是g/mol,C错误;标准状态下,1mol任何气体的体积约为22.4L,D错误。
点评:气体摩尔体积四要素:1mol、任何气体、标准状况、约为22.4L。
本题难度:简单