微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)
一定温度下,测得某纯水的pH为6.5。试计算:
(1)此时水的离子积常数Kw为多少?
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1。的Ba(OH)2溶液,保持原温度,其溶液的pH为多少?
(3)取上述Ba(OH)2溶液200mL,加入含0.01mol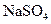 的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
参考答案:(1) (1分)
(1分)
(2)pH=1(2分)
(3) ?(3分)
?(3分)
本题解析:略
本题难度:简单
2、填空题 (4分)25℃时,下图烧杯中各盛有25 mL的溶液。

甲?乙?丙
(1)甲溶液pH=_______。
(2)若将甲溶液全部倒入乙中,所得的混合溶液的pH(填“>”、“<”或“=”)_______
丙溶液的pH。
(3)若将乙溶液全部倒入丙中,所得的混合溶液pH>7,所得溶液中离子浓度大小顺序是 _______。
参考答案:(1)1?(2)>?(3)c(NH4+)>c(Cl-)>c(OH-)>c(H+)
本题解析:(1)盐酸是强酸,0.100mol/L的盐酸PH=1,(2)恰好完全反应生成氯化铵,强酸弱碱盐水解显酸性,但是和丙相比,浓度远小于丙的浓度,所以混合后的溶液PH大于丙的溶液PH。(3)把乙溶液倒入丙中,相当于氨水和氯化铵等浓度等体积混合,氨水的电离程度大于铵根的水解程度,所以铵根浓度最大,其次是氯离子,溶液显碱性,所以氢氧根的浓度大于氢离子的浓度。
点评:解答本题需要注意的是“弱”的特点:弱酸,弱碱的电离,弱盐的水解,电离程度和水解程度的比较,溶液中离子浓度的大小关系比较,抓住主要离子的变化。
本题难度:简单
3、选择题 在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
?
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:D
本题解析:略
本题难度:一般
4、选择题 对于室温下pH=3的醋酸,下列叙述正确的是
A.加水稀释后,醋酸的电离程度增大,溶液的导电性增强
B.c(H+)=c(CH3COO-)+c(OH-)
C.加入少量醋酸钠固体后,恢复至室温,溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变
D.与等体积pH=11的NaOH溶液混合后,pH=7
参考答案:BC
本题解析:醋酸溶液存在如下平衡:CH3COOH H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变,因为c(CH3COO-)?c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
H++CH3COOˉ,稀释能促进醋酸的电离,但是c(H+)、c(CH3COOˉ)均减小,稀释后溶液的导电性减弱,故A错误;醋酸溶液存在的离子有氢离子、醋酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)=c(CH3COO-)+c(OH-),故B正确;加入醋酸钠固体,能增大c(CH3COOˉ),使醋酸的电离平衡左移,但是溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变,因为c(CH3COO-)?c(H+)/c(CH3COOH)的比值就是醋酸的电离平衡常数,只与温度有关,温度不变,平衡常数不变,故C正确;pH=3,醋酸溶液中c(H+)=0.001mol/L,由于醋酸部分电离出氢离子,则c(CH3COOH)>0.001mol/L,pH=11,NaOH溶液中c(OHˉ)=Kw/ c(H+)=0.001mol/L,由于NaOH完全电离,则c(NaOH)=0.001mol/L,因此c(CH3COOH)>c(NaOH),等体积混合时醋酸过量,混合后溶液呈酸性,pH<7,故D错误。
本题难度:一般
5、选择题 下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是( )
H++OH-向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液
D.将水加热到100°C,使pH=6
参考答案:B
本题解析:加入NaHSO4溶液,溶液显酸性,但抑制水的电离,不正确;加入Al2(SO4)3溶液,Al3+水解促进水的电离,同时水解使溶液显酸性,B正确;加入Na2CO3溶液,CO32—水解显碱性;将水加热促进其电离,氢离子浓度增加,但水依然是中性的。
本题难度:简单