微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向1.00 L 0.3 mol/L NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g。有关该溶液说法正确的是
[? ]
A.溶质为Na2CO3
B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(CO32-)>c(HCO3-)>c(H+)>c(OH-)
D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)?
参考答案:D
本题解析:
本题难度:一般
2、计算题 6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO。反应后溶液中含H+为
0.1mol。
(1)此时溶液中所含NO3-为____mol。
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)
参考答案:(1)0.3mol
(2)n(NO)=0.045a-0.55;n(NO2)=0.025-0.015a
本题解析:
本题难度:一般
3、计算题 用8.7 g MnO2和10 mol/L的盐酸120 mL反应制取Cl2。
(1)在标准状况下可生成多少升氯气?
(2)若把反应后的剩余溶液稀释成1L后,取出20 mL(不考虑HCl损失),在这20 mL溶液中加入足量AgNO3溶液,可得AgCl多少克?
参考答案:(1)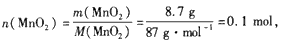
n( HCl)=10 mol/L×0.12L=1.2mol,
MnO2? +? 4HCl(浓) MnCl2+Cl2↑+2H2O?
MnCl2+Cl2↑+2H2O?
?1? ?4
0.1mol? 1.2 mol
盐酸过量,依MnO2的量来计算。
n(Cl2)=n(MnO2)= 0.1 mol,
故V(Cl2)=0.1 mol×22.4 L.mol-1=2. 24 L。
(2)由(1)可知n(Cl2)=0.1 mol,根据氯元素守恒,有:
n(Cl-)=n(HCl)-2n(Cl2)=1.2mol -2×0.1mol=1 mol。
在20 mL溶液中,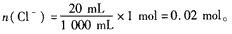
依 Cl-~AgCl,有:n(AgCl)=n(Cl-)=0. 02 mol。
故m( AgCl) = 0. 02 mol×143. 5g.mol-1=2. 87 g。
本题解析:
本题难度:一般
4、计算题 有一白色固体样品,进行焰色反应呈黄色。取该样品上2.74g加入足量的盐酸中,放出一种纯净的气体(阴离子全部与酸反应生成气体),将其通入足量澄清石灰水中得3g沉淀。经计算判断固体成分及物质的量之比。
参考答案:①n(Na2CO3)/n(NaHCO3)=1/2,②n(Na2SO3)/n(NaHSO3)=14/41
本题解析:
本题难度:一般
5、选择题 在相同条件下,将镁、铝、铁分别投入等质量且足量的稀硫酸中,反应结束后,三种溶液的质量仍相等,则投入镁、铝、铁三种金属的质量关系正确的是?
[? ]
A.Mg> Al> Fe
B.Al> Fe> Mg
C.Al> Mg> Fe
D.Fe> Mg> Al
参考答案:C
本题解析:
本题难度:一般