微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO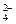 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
?
(1)判断BaCl2已过量的方法是?。
(2)第④步中,相关的离子方程式是?。
 (3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是?。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是?。
(4)为检验精盐纯度,需配制150 mL
0.2 mol/LNaCl(精盐)溶液,
右图是该同学转移溶液的示意图,
图中的错误是?。
参考答案:(1)取第②步后的上层清液1~2滴于点滴板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量




 (2)Ca2++CO
(2)Ca2++CO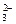 ?CaCO3↓
?CaCO3↓
 Ba2++CO
Ba2++CO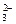 ?BaCO3↓
?BaCO3↓
(3)在此酸性条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(4)未用玻璃棒引流;未采用150 mL容量瓶
本题解析:(1)鉴别SO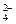 的特征试剂为含Ba2+的溶液,可取②步的上层清液再加BaCl2,看是否还产生沉淀来判断,若没有白色沉淀产生,则证明BaCl2已过量。
的特征试剂为含Ba2+的溶液,可取②步的上层清液再加BaCl2,看是否还产生沉淀来判断,若没有白色沉淀产生,则证明BaCl2已过量。
 (2)第④步的目的是为了除去Ca2+和过量的Ba2+,因此离子方程式应有Ca2++CO
(2)第④步的目的是为了除去Ca2+和过量的Ba2+,因此离子方程式应有Ca2++CO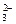 ?
?
 CaCO3↓,Ba2++CO
CaCO3↓,Ba2++CO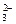 ? BaCO3↓。
? BaCO3↓。
(3)如果先加盐酸调pH值再过滤,可能使部分沉淀溶解,导致所得食盐不纯。
(4)配制一定物质的量浓度溶液时,要求所选容量瓶的容积应与待配制溶液的体积相等,即150 mL容量瓶;转移溶液时应用玻璃棒引流,而图中所示没有按要求做。
本题难度:一般
2、填空题 除去括号内杂质,应选用哪种试剂或方法,写出有关化学方程式:
(1)NaNO3(Na2SO4)_____________;__________________________
(2)KCl(KClO3)_____________;__________________________
(3)ZnSO4(CuSO4)_____________;__________________________
(4)Ag(Cu)_____________;__________________________
参考答案:(1)Ba(NO3)2;Ba(NO3)2+Na2SO4==BaSO4↓+2NaNO3
(2)MnO2加热;2KClO3 2KCl+3O2↑
2KCl+3O2↑
(3)Zn;CuSO4+Zn==ZnSO4+Cu
(4)AgNO3;Cu+2AgNO3==2Ag+Cu(NO3)2
本题解析:
本题难度:一般
3、选择题 用1 gNaOH固体配制成0.5 mol/LNaOH溶液,所得溶液的体积是
A.0.5 ml
B.5 ml
C.50 ml
D.500 ml
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列有关物质的分离提纯的方法和操作正确的是( )
A.用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从上口倒出
B.用溶解、过滤的方法分离KNO3和NaCl的混合物
C.可以用酒精萃取碘水中的碘
D.海水通过蒸馏可制得淡水,海水通过蒸发可得到粗盐
参考答案:A.四氯化碳密度比水大,应从下口流出,故A错误;
B.KNO3和NaCl都溶于水,不能用过滤的方法分离,可用重结晶的方法分离,故B错误;
C.酒精与会互溶,不能用作萃取剂,故C错误;
D.蒸发海水可得到粗盐,蒸馏海水可得到蒸馏水,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是?(?)
A.蒸发
B.蒸馏
C.升华
D.萃取
参考答案:D
本题解析:试题分析:A、蒸发适用于从溶液中得到固体溶质,是从溶液中将溶质分离出来的方法.如海水晒盐.不主要是从溶解性的角度考虑,故A不符合题意;
B、蒸馏是分离沸点不同的液体混合物的一种方法;不主要是从溶解性的角度考虑,故B不符合题意;
C、过滤分离固体与液体,主要利用物质的颗粒直径大小不同进行分离,故C不符合题意;
D、分离两种互不相溶的液体的方法为:萃取分液.利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,主要是从溶解性的角度考虑,故D符合题意
点评:理解不同类型的混合物的分离原理与方法(过滤、蒸馏、萃取、分液、结晶、蒸发等常见的方法要重点掌握)。
本题难度:简单