微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)如图所示的装置里,广口瓶内的物质A可以?是①干燥的氯化钠晶体;②干燥的氢氧化钠晶体;③蔗糖晶体;④乙醇;⑤氯化钠溶液;⑥氢氧化钠溶液;⑦稀盐酸;⑧蒸馏水;⑨SO3晶体中的哪几种?______________________?
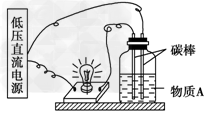
(2)简要回答(1)中所列物质不导电的原因及导电的原因。___________________________
参考答案:(1)⑤⑥⑦⑧
(2)①②不导电的原因是晶体状态下不能发生电离;③④⑨不导电的原因是它们属于非电解质;⑤⑥⑦⑧能导电的原因是NaCl、NaOH、HCl在水溶液中能发生电离,H2O自身可发生电离。
本题解析:
本题难度:一般
2、选择题 浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是
①Na2CO3溶液? ②NaHSO4溶液? ③NaCl溶液? ④AlCl3溶液
A.①<②<③<④
B.①<③<④<②
C.②<④<③<①
D.④<③<②<①
参考答案:C
本题解析:试题分析:按照溶液的pH可以分成三类,酸性、碱性、中性。 ②NaHSO4溶液是酸式盐,溶液显酸性,酸性最强。④AlCl3溶液是强酸弱碱盐,水解后显示酸性;③NaCl溶液是强酸强碱盐,不水解,显示中性; ①Na2CO3溶液 是强碱弱酸盐,水解显示碱性,所以浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是②<④<③<①?,故选C。
考点:盐的水解
点评:在此小结一下盐的水解:
⒈实质:在溶液中,由于盐电离出的离子于水电离出的离子结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离的方向移动,显示出不同浓度的酸性、碱性或中性。[1]
⒉规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性,弱弱具体定;越热越水解,越稀越水解。
(即盐的构成中出现弱碱阳离子或弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,水解程度越大,溶液的pH变化越大;水解后溶液的酸碱性由构成该盐离子对应的酸和碱相对强弱决定,酸强显酸性,碱强显碱性。)
本题难度:简单
3、选择题 电解质溶液显电中性的原因是( )
A.溶液中阴、阳离子数相等
B.溶液中阴、阳离子所带电荷数相等
C.溶液中阴、阳离子所带电荷总数相等
D.溶液中没有离子,不带电
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列物质的水溶液能导电,但该物质属于非电解质的是?
[? ]
A.HClO
B.Cl2?
C.NaHCO3
D.CO2
参考答案:D
本题解析:
本题难度:简单
5、填空题 现有下列物质?①NaCl晶体?②干冰?③液态醋酸?④铜?⑤BaSO4固体?⑥蔗糖?⑦酒精 ⑧熔融的KNO3 ⑨液氧?⑩硫酸溶液
(1)以上物质能导电的是______;
(2)以上物质属于电解质的是______.
参考答案::①NaCl晶体是电解质;②干冰是非电解质;③液态的醋酸是电解质;?④铜能导电,既不是电解质也不是非电解质;?⑤BaSO4固体是电解质;?⑥蔗糖是非电解质;
⑦酒精是非电解质; ⑧熔融的KNO3是电解质且能导电;⑨液氧是单质既不是电解质也不是非电解质;⑩硫酸溶液是混合物,能导电.
故答案为:④⑧⑩;①③⑤⑧;
本题解析:
本题难度:一般