微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)把煤作为燃料可以通过下列两种途径:
途径I:C(s)+O2(g)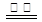 CO2(g) ΔH=E1 ①
CO2(g) ΔH=E1 ①
途径II:先制水煤气:C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
再燃烧水煤气:H2(g)+1/2O2(g)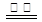 H2O(g) ΔH=E3?③
H2O(g) ΔH=E3?③
CO(g)+1/2O2(g)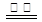 CO2(g) ΔH=E4④ ,试回答下列问题:
CO2(g) ΔH=E4④ ,试回答下列问题:
(1)判断两种途径放热:途径I放出的热量 _____(填“大于”、“等于”、“小于”)途径II放出的热量。
_____(填“大于”、“等于”、“小于”)途径II放出的热量。
(2)E1、E2、E3、E4的数学关系式 是_____________________________________。
是_____________________________________。
(3)由于制取水煤气反应里,反应物所具有的总能量_______(填“大于”、“等于”、“小于”)生成物所具有的总能量,正反应又是熵增加的反应,为了让该反应自发进行,要使反应条件为_______。
参考答案:(1)等于?(2)E1=E2+E3+E4?(3)小于,高温
本题解析:略
本题难度:一般
2、选择题 某可逆反应过程能量变化如图所示,下列说法中正确的是? ( )
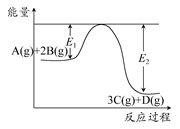
A.该反应热化学方程式为A(g)+2B(g)  3C(g)+D(g) ΔH>0
3C(g)+D(g) ΔH>0
B.其他条件不变,升高温度,A的转化率增大
C.其他条件不变,增大压强,释放热量减少,平衡常数K减小
D.其他条件不变,加催化剂,反应速率增大,E1和E2均减小,ΔH不变
参考答案:D
本题解析:由于E2>E1,则ΔH<0,A错误;对于放热反应,升高温度,平衡逆向移动,A的转化率减小,B错误;K只与温度有关,增大压强,K不变,C错误;催化剂能降低E1,E2也相应减小,v增大,但ΔH不变。
本题难度:一般
3、选择题 下列说法中错误的是
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
D.需要加热才能发生的化学反应一定是吸热反应
参考答案:D
本题解析:A.化学反应的过程是旧键断裂、新键形成的过程,所以通常伴随着能量变化。而这种能量变化通常表现为热量的变化。正确。B.化学反应的过程就是原子重新组合的过程。在这个过程中,反应物中的化学键断裂消耗能量。原子形成化学键又释放能量。化学键的断裂和形成是化学反应中能量变化的主要原因。正确。C.如果反应物总能量高于生成物总能量的总能量,发生的反应就是放热反应,否则就是吸热反应。所以二者的相对大小决定了反应是放出能量还是吸收能量。正确。D.任何反应的发生都需要一个活化的过程。这与反应是否是放热或吸热反应无关。错误。
本题难度:简单
4、填空题 (4分)氢气燃烧生成液态水的热化学方程式是:
2H2(g)+O2(g) ===2H2O(l)?ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和 (填“大于” 、“小于”或“等于”)反应物能量总和。
、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量?(填“>”、“<”或“=”)572 kJ。
参考答案:(4分)(1)小于?(2)<?(每空2分)
本题解析:略
本题难度:一般
5、选择题 已知反应A+B===C+D为放热反应,对该反应的下列说法中正确的是(? )
A.A的能量一定高于C
B.B的能量一定高于D
C.A和B的能量总和一定高于C和D的能量总和
D.因该反应为放热反应,故不必加热就可自动进行
参考答案:C
本题解析:放热反应是指反应物的总能量高于产物的总能量
本题难度:一般