微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 只用一种试剂就能鉴别出NH4Cl、Na2SO4、(NH4)2CO3、三种溶液,应选用
A.BaCl2
B.HCl
C.NaOH
D.Ba(OH)2
参考答案:D
本题解析:Ba(OH)2使NH4Cl产生气体,Na2SO4产生沉淀,(NH4)2CO3产生沉淀和气体。故答案为D。
本题难度:一般
2、填空题 工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
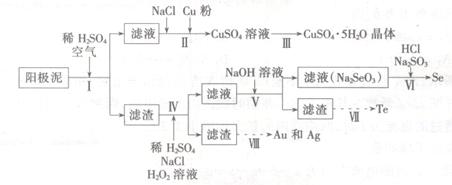
已知:①阳极泥的主要化学成分,如表1所示
表一
主要成份
| Cu? Ag? Au? Se? Te
|
百分含量/%
| 23.4? 12.1? 0.9? 6.7? 3.1
|
?
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
?
| 固定浸出温度
| ?
| ?
| 固定H2SO4浓度
|
H2SO4浓度
mol/L
| 浸出率/%
| ?
| 浸出温度/℃
| 浸出率/%
|
Cu? Ag? Au? Se? Te
| ?
| Cu? Ag? Au? Se? Te
|
4
| 95.1 4.67? <0.2? 0.83 8.93
| ?
| 30
| 87.1 4.58? <0.2 0.08 6.83
|
3
| 94.5 4.65? <0.2? 0.28 6.90
| ?
| 40
| 94.5 4.65? <0.2? 0.28 6.90
|
2
| 78.1 2.65? <0.2? 0.05 2.85
| ?
| 50
| 96.1 5.90? <0.2? 0.64 8.73
|
?
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为?。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为?。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为?;此过程中H2O2溶液的添加量要远远高于理论值,原因为?。
(5)步骤Ⅵ中所发生反应的化学方程式为?。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为?。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸?B.浓盐酸?C.浓氢氡化钠溶液?D.王水
参考答案:(1)2Cu+O2+2H2SO4=2CuSO4+2H2O?硫酸浓度3 mol·L-1、浸出温度40℃
(2)除去滤液中的Ag+
(3)加热浓缩(蒸发)、冷却结晶、过滤
(4)氧化滤渣中的硒和碲,使其进入溶液中,增加硒和碲的浸出率。H2O2会有部分分解。
(5)Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O
(6)TeO32-+4e-+3H2O=Te+6OH-
(7)A
本题解析:(1) 步骤I的主要过程中发生的主要反应的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.由表2数据可知:硫酸的浓度越大,Cu浸出率越高。在硫酸的浓度不变时,温度越高Cu浸出率越高。但是浓度太高,杂质Se、Te的浸出率也越高;温度越高,Ag、Se、Te的浸出率也越高。综合考虑纯度、能耗等,最合适的条件是硫酸浓度3 mol/L、浸出温度40℃.(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为利用AgCl的不溶性来除去滤液中的杂质离子Ag+。(3)步骤Ⅲ从硫酸铜溶液中得到硫酸铜晶体的操作方法为加热浓缩(蒸发)、冷却结晶、过滤。(4)步骤Ⅳ中,加入H2O2溶液的作用为把滤渣中的硒和碲氧化为离子,使其进入溶液中,增加硒和碲的浸出率。此过程中H2O2溶液的添加量要远远高于理论值是因为H2O2不稳定,受热容易分解,有H2O2会有部分发生了分解反应。(5)根据过程示意图及氧化还原反应的特征与实质,可知步骤Ⅵ中所发生反应的化学方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O。(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,Te应该在阴极得到。其阴极的电极反应式为TeO32-+4e-+3H2O=Te+6OH-。(7)因为Au与常见的试剂都不能发生反应。而Ag则能与硝酸反应得到硝酸银溶液。所以步骤Ⅷ中得到的Au和Ag混合物可以用硝酸溶解,然后进行过滤分离。选项为A。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值.下列叙述正确的是
A.常温常压下的33.6L氯气与足量铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.在1molNa2O2晶体中阳离子与阴离子总数为4NA
参考答案:C
本题解析:分析:A、根据不是标准状况,则无法计算氯气的物质的量;
B、标准状况下,己烷为液态;
C、利用极限法及物质的化学式来分析氧原子的数目;
D、根据1molNa2O2晶体中存在2molNa+和1molO22-来分析.
解答:A、33.6L氯气不是标准状况,则无法计算来确定反应中转移的电子数,故A错误;
B、因标准状况下己烷为液态,无法计算确定己烷的物质的量,故B错误;
C、若NA个分子全为CO2,其氧原子数为2NA,若NA个分子全为O2,其氧原子数也为2NA,即由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA,故C正确;
D、1molNa2O2晶体中存在2molNa+和1molO22-,则1mol?Na2O2晶体中阳离子与阴离子总数为3NA,故D错误;
故选C.
点评:本题考查有关物质的量及阿伏伽德罗常数的计算,明确物质的状态、气体是否在标准状况下、物质的构成、物质的电子式是解答本题的关键.
本题难度:困难
4、填空题 选择适当的试剂和物质分离的方法,除去括号中的杂质:
(1)甲烷(乙烯) 所用试剂__________, 方法_______________。
(2)乙酸乙酯(乙酸)所用试剂__________, 方法________________。
参考答案:(1)溴水(或KMnO4酸性溶液和碱石灰);洗气
(2)饱和Na2CO3溶液;分液
本题解析:
本题难度:一般
5、选择题 仅用一种试剂鉴别苯酚溶液、己烷、己烯、乙醇4种物质,可选用的是
A.浓溴水
B.FeCl3溶液
C.蒸馏水
D. NaOH溶液
参考答案:A
本题解析:浓溴水和苯酚反应生成白色沉淀,和己烷发生萃取,和己烯发生加成反应,和乙醇互溶,可以鉴别,A正确;氯化铁溶液只能鉴别苯酚和乙醇,不能鉴别己烷和己烯,B不正确;蒸馏水不能鉴别己烷和己烯,C不正确。氢氧化钠溶液和己烷、己烯均不反应,混合后分层,和乙醇互溶,和苯酚反应没有明显的现象,无法鉴别,答案选A。
点评:进行物质的检验和鉴别时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。如果是有机物,则需要依据官能团性质的不同进行鉴别。
本题难度:一般