微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法不正确的是?
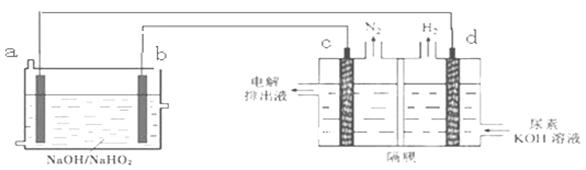
A.燃料电池的总反应为:2Al+3HO2-= 2AlO2- + OH- +H2O
B.电极b是正极,且反应后该电极区pH增大
C.电解过程中,电子的流向由a→b→c→d.
D.电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L
参考答案:D
本题解析:A、Al—H2O2燃料电池Al为负极,总反应为Al+3H2O2+OH-=AlO2-+HO2-+3H2O,错误;B、根据电解池中d极产生H2应为H+放电,故d为阴极,所以a是负极,b为正极,正极区电极反应为H2O2结合OH-生成HO2-,所以pH减小,B错误;C、根据上面分析,a为负极故电子流向为a→d,c→b,错误;D、由CO(NH2)2→N2,每生成1molN2,转移6mol电子,需要消耗2molAl,故消耗2.7gAl(0.1mol)转移0.3mol电子,可生成0.05molN2,标准状况下体积为1.12L,正确。
本题难度:一般
2、选择题 通过NOx传感器可监测NOx的含量,其工作原理示意图如下:下列说法正确的是 (?)

A.NiO电极发生还原反应
B.Pt电极是电池的负极
C.NiO 电极的电极反应式:NO—2e—+O2—=NO2
D.该电池在标准状况下,若Pt电极消耗2.24L O2,NiO电极电极产生2.24LNO2气体
参考答案:C
本题解析:A、NiO 电极NO失去电子生成NO2,为负极,发生氧化反应,错误;B、Pt电极氧气得到电子生成O2-,为正极,错误;C、正确;D、NiO电极电极产生4.48LNO2气体,错误。
本题难度:一般
3、选择题 下图是水煤气(成分为CO、H2)、空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是

A.A处通入的是空气,B处通入的是水煤气
B.a电极发生还原反应,b电极发生氧化反应
C.如用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下的水煤气2.24 L
D.a电极的反应式包括:CO+4OH-+2e-=CO32-+2H2O
参考答案:C
本题解析:本题考查的是原电池的应用-燃料电池的工作原理。不管什么燃料电池,若需要消耗氧气,那么通O2的这一极一定是正极。正极得电子,发生还原反应。负极失电子,发生氧化反应。外电路中电子由负极经过导线回到正极。而内电路(溶液中)靠离子定向移动产生电流。电子的流向可知,电子从a极出来,回到b极。所以a是负极(燃料失电子),b极是正极(O2得电子)。故A错误。负极电极反应式:不仅CO失电子,还有H2失电子。CO失电子后变成+4价(以CO2形式存在)而电解质溶液是碱性溶液,所以CO2会与OH-发生反应生成CO32-。故电极反应为:CO+4OH--2e-= CO32-+2H2O。配平时不仅满足电子守恒,还有电荷守恒和原子守恒。同理可写出H2的反应:H2+2OH--2e-=2H2O。所以漏了H2的反应式。故B错误。如用这种电池电镀铜,当镀件增重6.4gCu,说明n(Cu)=0.1mol。转移n(e-)=0.2mol。1molCO转移2mol e-,1mol H2转移2mol e-。1molCO和H2的混合气体也是转移2mol e-。现增重6.4gCu,转移0.2mol e-,所以消耗CO? 0.1mol或0.1mol H2或CO和H2的混合气体0.1mol。故C正确。a电极是负极,发生氧化反应。b电极是正极,得到电子,发生还原反应。故D错误。
本题难度:一般
4、选择题 下列叙述中,不正确的是
[? ]
A.原电池是将化学能转化为电能的装置
B.轮船底部镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁腐蚀的负极反应:Fe-3e-=?Fe3+
D.电镀时,镀层金属作阳极,镀件作阴极
参考答案:C
本题解析:
本题难度:简单
5、选择题 某原电池的总反应是Zn +Cu2+=Zn2++ Cu,该原电池的正确组成是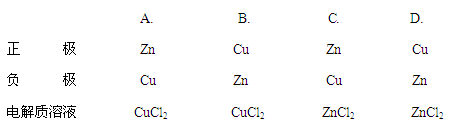
参考答案:B
本题解析:本题考查的是原电池的有关内容。从理论上讲,氧化还原反应均可设计成原电池。发生氧化反应的物质是负极,发生还原反应的是正极。本题中电极反应为:
正极:Cu2++2e- Cu
Cu
负极:Zn-2e- Zn2+
Zn2+
B正确。故本题选B。
本题难度:一般