微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向20 mL氢氧化钠溶液中逐滴加入0. 2 mol/L醋酸溶液,滴定曲线如下图所示下列说法不正确的是?(?)
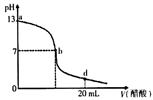
A.该氢氧化钠溶液的物质的量浓度为0.1 mol/L .
B.在b点,c (Na+)=c(CH3COO-)
C.在d点,溶液中所有离子浓度由大到小的顺序为
c (CH3COO-)>c (Na+)>c (H+)>c (OH-)
D.氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点
参考答案:D
本题解析:由图像得:V(醋酸)=0时,PH=13,即氢氧化钠溶液的PH=13,则C(OH-)="0.1" mol/L,故A正确;
在b点时,PH=7,则[H+]=[OH-],再利用电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-],故B正确;
在d点时,NaOH+CH3COOH=CH3COONa+H2O反应后,溶液变成为等浓度的CH3COOH、CH3COONa的混合物(前者考虑电离平衡,后者考虑水解平衡):PH<7,即:c (H+)>c (OH-),且同样存在电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-], 则:[Na+]<[CH3COO-],故C正确;
氢氧化钠溶液与醋酸溶液恰好完全反应时,生成CH3COONa,CH3COONa水解呈碱性,PH>7,故应是位于曲线a、b间的某点,故D错误;
本题难度:一般
2、选择题 在200 mL某硫酸盐溶液中含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为(? )
A.1 mol·L-1
B.2.5 mol·L-1
C.5 mol·L-1
D.2 mol·L-1
参考答案:B
本题解析:
正确答案:B
有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的化学式为M2 (SO4)3 , 该硫酸盐的物质的量浓度为1.5mol÷3÷0.200L="2.5" mol·L-1,故B正确。
本题难度:一般
3、选择题 常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(N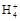 )=c(Cl-)
)=c(Cl-)
C.若混合液的pH=7,则混合液中c(N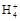 )>c(Cl-)
)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
参考答案:A
本题解析:如果二者恰好完全反应(c1V1=c2V2),则生成物为NH4Cl,水解显酸性,要使溶液显中性,则氨水要过量,即c1V1>c2V2,A正确,根据电荷守恒,则B和C都不正确,当c1V1=c2V2时,溶液显酸性,混合液的pH<7,则D不正确。
本题难度:一般
4、选择题 某探究小组在某温度下测定溶液的pH时发现:0.01 mol/L的NaOH的溶液中,由水电离出的C(OH-).C(H+) = 10-22 (mol/L)2,则该小组在该温度下测得0.1 mol/L NaOH溶液的pH应为 (?)
A.13
B.12
C.11
D.10
参考答案:B
本题解析:0.01 mol/L的NaOH的溶液中,因NaOH是强碱,完全电离,则CNaOH(OH-)=10-2 mol/L;
由水电离出的C(OH-).C(H+) = 10-22 (mol/L)2,得: C水(H+)= C水(OH-)=10-11,
所以:在该温度下,Kw= C水(H+)×CNaOH(OH-)=10-13 (mol/L)2;
则0.1 mol/L NaOH溶液中:C水(H+)=" Kw" / CNaOH(OH-)=10-13/10-1=10-12 mol/L,PH=12
本题难度:一般
5、选择题 已知火箭燃料二甲基肼(CH3—NH—NH—CH3)的燃烧热为-6 000 kJ·mol-1,则30 g二甲基肼完全燃烧放出的热量为
A.3000 kJ
B.1500 KJ
C.6 000 kJ
D.12 000 kJ