微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1 mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为 (?)?
A.0.8mol
B.1.6mol
C.2mol
D.4mol
参考答案:A
本题解析:HBr的还原性比SO2小,所以,通入1 mol Cl2时,氯气先与二氧化硫反应,二氧化硫反应完全后再与HBr反应;设混合气体中二氧化硫的物质的量为x,由方程式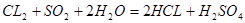 可得,x mol二氧化硫要消耗x mol氯气,由方程式
可得,x mol二氧化硫要消耗x mol氯气,由方程式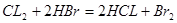 可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=
可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=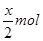 ,得x=0.8mol
,得x=0.8mol
本题难度:一般
2、选择题 下列中的实验一定不会出现沉淀现象的是
A.CO2气体通入Na2SiO3溶液中
B.SO2气体通入BaCl2溶液中
C.CO2气体通入饱和Na2CO3溶液中
D.SO2气体通入Ba(OH)2溶液中
参考答案:B
本题解析:A、碳酸的酸性强于硅酸,因此CO2气体通入Na2SiO3溶液中产生硅酸沉淀;B、SO2与氯化钡不反应;C、碳酸氢钠的溶解度小于碳酸钠的溶解度,因此CO2气体通入饱和Na2CO3溶液中产生碳酸氢钠沉淀;D、SO2气体通入Ba(OH)2溶液中可以产生亚硫酸钡沉淀,故答案选B。
本题难度:一般
3、选择题 根据卤素性质的递变规律,推测原子半径最大的卤素-----砹(At)及其化合物不可能具有的性质是
A.砹单质为有色固体,易溶于有机溶剂;
B.HAt十分稳定;
C.AgAt为有色的、难溶于水的盐;
D.NaAt易溶于水。
参考答案:B
本题解析:同主族自上而下非金属性逐渐增强,相应氢化物的稳定性也是逐渐增强,HAt的稳定性最弱,选项B不正确,根据卤素元素及其单质的性质递变规律可知,其余都是正确的,答案选B。
本题难度:简单
4、实验题 某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。
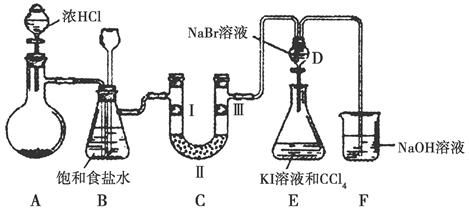
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:____________________________________。
参考答案:(1)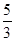
(2)B中长颈漏斗中液面上升,形成液柱
(3)无水氯化钙(硅胶、P2O5)、干燥的有色布条
(4)打开A中分液漏斗活塞,一段时间后,D中的无色溶液变为橙色(橙红色或黄色),说明氯的非金属性大于溴;打开D中活塞,将D中少量溶液放入装置E中,振荡,下层为紫红色,说明溴的非金属性大于碘
(5)Cl2+2NaOH=NaCl+NaClO+H2O
(6)S O32-+Cl2+H2O=SO42-+2Cl-+2H+、SO32-+2H+=SO2↑+H2O
本题解析:(1)KClO3与浓盐酸发生反应:KClO3+6HCl=3Cl2+KCl+3H2O,由氧化还原反应可知,生成3 mol Cl2,转移5 mol电子,因此当产生1 mol Cl2时,转移电子的物质的量为5/3 mol。(2)若装置C发生堵塞,则B内压强变大,导致B中长颈漏斗中液面上升,形成液柱。(3)为做对比,看干燥的氯气是否具有漂白性,Ⅱ处应放吸水剂,Ⅲ处放干燥的有色布条。
点拨:本题考查物质的制备与性质验证实验等,考查考生的实验能力。难度中等。
本题难度:一般
5、选择题 下列化合物不能通过单质直接化合而制得的是( )
A.CuCl2
B.AlCl3
C.FeCl2
D.NaCl
参考答案:A、单质铜和氯气化合生成CuCl2,故A不符合;
B、铝和氯气反应生成AlCl3,故B不符合;
C、铁和氯气反应生成FeCl3,故C符合;
D、钠和氯气生成NaCl,故D不符合;
故选:C.
本题解析:
本题难度:一般