微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
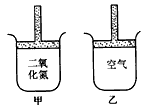
1、选择题 常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮和空气,现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2kg的砝码;在以上两情况下,甲和乙容器的体积大小的比较,正确的是
[? ]
A.①甲>乙②甲>乙
B.①甲>乙②甲<乙
C.①甲<乙②甲>乙
D.①甲>乙②甲=乙
参考答案:B
本题解析:
本题难度:一般
2、填空题 (14分)物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
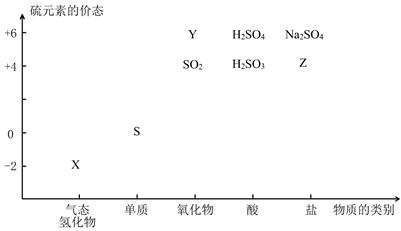
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S+ S b. Z+ S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为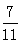 ,则SO2的转化率为 。
,则SO2的转化率为 。
参考答案:(1)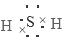 (1分);弱(1分)电子层数增多,原子半径增大
(1分);弱(1分)电子层数增多,原子半径增大
(2)①b、d(选对1个给1分,错选或多选为0分)② b
(3)①2CO(g) + SO2(g)="==" S(s) + 2CO2(g) △H=-270 kJ/mol;②c、d; 60%。
本题解析:(1)-2价的气态H2S是共价化合物,其电子式是: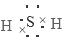 ,其水溶液长期在空气中放置容易变浑浊,是由于发生反应:2H2S+O2=2H2O+2S↓,该变化体现出元素的非金属性S<O;原因是同主族元素最外层电子数相同,从上到下,元素原子的核外电子层数逐渐增多,原子半径逐渐增大,原子失去电子的能力逐渐增强,获得电子的能力逐渐减弱。所以元素的非金属性逐渐减弱;(2) Na2S2O3是一种用途广泛的钠盐。① 下列物质用于Na2S2O3的制备,由于在Na2S2O3中S元素的化合价为+2;所以制取该物质中S元素的化合价应该有比+2高的价态,也有比+2价低的价态。从图表关系可知Y是SO3;Z是H2SO4。从氧化还原反应的角度,a. Na2S+ S,S的价态都比+2价低,不能反应产生Na2S2O3,错误;b. Z+ S中H2SO4中的S为+6价,S单质中S化合价为0价,可以反应产生Na2S2O3,正确;c. Na2SO3 + Y 中的S的化合价分别是+4价、+6价,都高于+2价,不可以制取Na2S2O3,错误; d. NaHS + NaHSO3中的S的化合价分别是-2价、+4价,有高于+2价,也有低于+2价的,可以制取Na2S2O3,正确。故选项是bd;(3)①:①×2-②,整理可得:2CO(g) + SO2(g)="==" S(s) + 2CO2(g) △H=-270 kJ/mol ;②② 一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应2CO(g) + SO2(g)="==" S(s) + 2CO2(g), a. 由于加入的两种物质发生反应时物质的量的比是2:1,所以在任何时刻都存在v (CO) ∶v(SO2) = 2∶1,因此不能判断反应处于平衡状态,错误;b.反应的平衡常数只与温度有关,无论反应是否处于平衡状态,在某温度下的平衡常数都不变,因此不能判断反应处于平衡状态,错误; c. 由于该反应是反应前后气体质量发生改变的反应,若反应处于平衡状态,则气体的质量不变,气体的物质的量不变,反应处于平衡状态,所以气体密度不变 可证明反应处于平衡状态,正确;d. CO2是生成物, SO2是反应物,若二者的体积比保持不变,则气体的物质的量都不发生变化,反应处于平衡状态,正确。故选项是cd。假设原通入的气体SO2的物质的量是1mol,则CO的物质的量是4mol,反应过程消耗的SO2的物质的量是xmol,则反应达到平衡时,各种气体的物质的量分别是:n(CO)=(4-2x)mol;n(SO2)=(1-x)mol;n(CO2)=2xmol。由于测得上述反应达平衡时,混合气体中CO的体积分数为
,其水溶液长期在空气中放置容易变浑浊,是由于发生反应:2H2S+O2=2H2O+2S↓,该变化体现出元素的非金属性S<O;原因是同主族元素最外层电子数相同,从上到下,元素原子的核外电子层数逐渐增多,原子半径逐渐增大,原子失去电子的能力逐渐增强,获得电子的能力逐渐减弱。所以元素的非金属性逐渐减弱;(2) Na2S2O3是一种用途广泛的钠盐。① 下列物质用于Na2S2O3的制备,由于在Na2S2O3中S元素的化合价为+2;所以制取该物质中S元素的化合价应该有比+2高的价态,也有比+2价低的价态。从图表关系可知Y是SO3;Z是H2SO4。从氧化还原反应的角度,a. Na2S+ S,S的价态都比+2价低,不能反应产生Na2S2O3,错误;b. Z+ S中H2SO4中的S为+6价,S单质中S化合价为0价,可以反应产生Na2S2O3,正确;c. Na2SO3 + Y 中的S的化合价分别是+4价、+6价,都高于+2价,不可以制取Na2S2O3,错误; d. NaHS + NaHSO3中的S的化合价分别是-2价、+4价,有高于+2价,也有低于+2价的,可以制取Na2S2O3,正确。故选项是bd;(3)①:①×2-②,整理可得:2CO(g) + SO2(g)="==" S(s) + 2CO2(g) △H=-270 kJ/mol ;②② 一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应2CO(g) + SO2(g)="==" S(s) + 2CO2(g), a. 由于加入的两种物质发生反应时物质的量的比是2:1,所以在任何时刻都存在v (CO) ∶v(SO2) = 2∶1,因此不能判断反应处于平衡状态,错误;b.反应的平衡常数只与温度有关,无论反应是否处于平衡状态,在某温度下的平衡常数都不变,因此不能判断反应处于平衡状态,错误; c. 由于该反应是反应前后气体质量发生改变的反应,若反应处于平衡状态,则气体的质量不变,气体的物质的量不变,反应处于平衡状态,所以气体密度不变 可证明反应处于平衡状态,正确;d. CO2是生成物, SO2是反应物,若二者的体积比保持不变,则气体的物质的量都不发生变化,反应处于平衡状态,正确。故选项是cd。假设原通入的气体SO2的物质的量是1mol,则CO的物质的量是4mol,反应过程消耗的SO2的物质的量是xmol,则反应达到平衡时,各种气体的物质的量分别是:n(CO)=(4-2x)mol;n(SO2)=(1-x)mol;n(CO2)=2xmol。由于测得上述反应达平衡时,混合气体中CO的体积分数为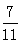 ,则(4-2x)mol ÷(5-x)mol=
,则(4-2x)mol ÷(5-x)mol=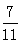 .解得x=0.6mol,所以SO2的转化率为(0.6mol÷1mol)×100%=60%。
.解得x=0.6mol,所以SO2的转化率为(0.6mol÷1mol)×100%=60%。
考点:考查物质的电子式的书写、元素非金属性强弱比较、盖斯定律的应用、热化学方程式的书写、化学平衡状态的判断及物质平衡转化率的计算的知识。
本题难度:困难
3、填空题 (10分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)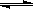 C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。

试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为____________。
(2)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=________,该反应为_______反应(填吸热或放热)。
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
参考答案:(1)0.24mol·L—1·min—1;(2)AB ;(3)0.9,吸热;(4)向正反应方向
本题解析:(1)v(D)=0.6/(1×5)mol/(L·min)=0.12mol/(L·min),利用反应速率之比等于化学计量数之比,v(B)=2v(D)=2×0.12mol/(L·min)=0.24mol/(L·min);(2)反应前后气体系数之和不相等,压强之比等于物质的量之比,压强随反应减小,当压强不变时,说明反应达到平衡,可以作为判断平衡的标志;B、根据化学平衡状态的定义,组分的浓度不变,可以判断达到化学平衡状态的依据;C、不同种物质的速率表示达到平衡的依据,要求反应方向一正一逆,速率之比是等于系数之比,v正(B)反应向正反应方向进行,v逆(D)反应向逆反应方向进行,v正(B):v逆(D)=2:1,v正(B)=2v逆(D),错误;D、没有说明反应的方向,错误;选项AB正确;(3)
A(g)+2B(g)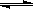 C(g)+D(g)
C(g)+D(g)
起始量: 1.0 2.2 0 0
变化量: 0.6 1.2 0.6 0.6 K=[c(D)×c(C)]/[c(A)×c2(B)]=(0.6×0.6)/(0.4×12)=0.9
平衡量: 0.4 1 0.6 0.6
(4)此时的浓度商=[c(D)×c(C)]/[c(A)×c2(B)]=(0.9×0.9)/(1.1×2.62)=0.1<0.9,向正反应方向进行。
考点:考查化学反应速率的计算、判断化学反应达到平衡的依据、平衡常数的计算等知识。
本题难度:困难
4、填空题 (7分)在一定条件下,xA + yB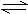 zC,反应达到平衡,试填写下列空白:
zC,反应达到平衡,试填写下列空白:
(1)若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是 。
(2)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动,且A、B的状态中至少有一种是 。
(3)加热后C的百分含量减少,则正反应是 反应(选填“吸热”、“放热”)。
参考答案:

本题解析:略
本题难度:一般
5、填空题 在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。
(1)N2(g)+?O2(g)=2NO(g)?△H=+180.5?kJ/mol?
2C(s)+?O2(g)=2CO(g)?△H=-221.0?kJ/mol?
C(s)+?O2(g)=CO2(g)?△H=-393.5?kJ/mol?
写出NO(g)与CO(g)反应的热化学方程式____________________。
(2)某研究性学习小组在技术人员的指导下,在某温度时按下列流程探究催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表

①前2s内的平均反应速率v?(N2)?=__________。
②列式计算该温度下反应的平衡常数K_______________。
③对于该可逆反应,下列叙述正确的是___________(填序号)。
A.该反应在一定条件下能自发进行
B.该反应能有效减少有害气体的排放
C.该反应一旦发生将在很短的时间内完成?
D.该反应达到平衡时CO、NO的转化率相等
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列叙述错误的是____(填序号)。

A.负极的电极反应式为:CO+O2--2e-=CO2?
B.工作时O2-在固体介质中由电极a流向电极b
C.工作时电子由电极a通过电流计流向电极b
D.电流计中显示的电流越大,汽车尾气中CO的含量越高
参考答案:(1)2NO(g)+2CO(g)=N2(g)+2CO2(g)? △H=-746.5 kJ/mol
(2)①1.875×10-4 mol·L-1·s-1;②5.00 ×103;③ABC
(3)B
本题解析:
本题难度:一般