微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (16分)甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:
Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为: 。
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因 。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式____。

实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| 10min
| 20min
| 30min
| 40min
| 50min
| 60min
|
3000C
| 0.40
| 0.60
| 0.75
| 0.84
| 0.90
| 0.90
|
5000C
| 0.60
| 0.75
| 0.78
| 0.80
| 0.80
| 0.80
|
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________。
(3)5000C平衡常数K=___________。
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为 。
参考答案:Ⅰ、CH4+H2O(g)  CO+3H2,(2分) CO2+H2
CO+3H2,(2分) CO2+H2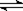 CO+H2O。(2分) 3:1 (2分)
CO+H2O。(2分) 3:1 (2分)
Ⅱ.(1)CO(g)+2H2(g) 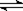 CH3OH(g) ΔH="(a-b)kJ/mol" [ΔH=-(b-a)kJ/mol (3分)
CH3OH(g) ΔH="(a-b)kJ/mol" [ΔH=-(b-a)kJ/mol (3分)
(2) 0.080mol/(L·min) (2分) (3) 25 (2分) (4) 80% (3分)
本题解析:Ⅰ、制备合成气:
天然气的主要成分是甲烷,则用天然气和水制取原料气的方程式为CH4+H2O(g)  CO+3H2。由于在一定条件下CO2能与氢气反应生成CO和水,即CO2+H2
CO+3H2。由于在一定条件下CO2能与氢气反应生成CO和水,即CO2+H2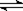 CO+H2O,所以原料气中常添加CO2以解决合成气中H2过量CO不足问题。CO和氢气按照1:2混合时恰好反应生成甲醇,为了使合成气配比最佳,可设甲烷的物质的量是x,CO2是y。甲烷产生的CO和氢气分别是x和3x,CO2消耗的氢气和产生的CO均是y,则有
CO+H2O,所以原料气中常添加CO2以解决合成气中H2过量CO不足问题。CO和氢气按照1:2混合时恰好反应生成甲醇,为了使合成气配比最佳,可设甲烷的物质的量是x,CO2是y。甲烷产生的CO和氢气分别是x和3x,CO2消耗的氢气和产生的CO均是y,则有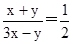 ,解得x:y=3:1。
,解得x:y=3:1。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示,根据图像可知反应放出的能量是bkJ—akJ,则合成甲醇的热化学方程式为CO(g)+2H2(g) 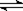 CH3OH(g) ΔH=—(b-a)kJ/mol。
CH3OH(g) ΔH=—(b-a)kJ/mol。
(2)在3000C反应开始10分钟内生成甲醇的物质的量浓度是0.4mol/L,则根据方程式CO(g)+2H2(g)  CH3OH(g)可知消耗氢气的浓度是0.8mol/L,所以H2的平均反应速率=0.8mol/L÷10min=0.080mol/(L·min)。
CH3OH(g)可知消耗氢气的浓度是0.8mol/L,所以H2的平均反应速率=0.8mol/L÷10min=0.080mol/(L·min)。
(3)5000C时反应进行到40min时达到平衡状态,产生甲醇是0.8mol/L,则消耗CO和氢气的浓度分别是0.8mol/L和1.6mo/L,则平衡时CO和氢气的浓度分别是0.2mol/L和0.4mol/L。根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知500℃时平衡常数K=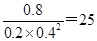 。
。
(4) CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
起始量(mol) 1.2 2 0
转化量(mol) x 2x x
平衡量(mol)1.2-x 2—2x x
所以根据平衡时容器内压强为起始的一半可知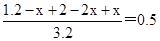
解得x=0.8mol
因此氢气的转化率是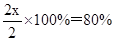
考点:考查可逆反应平衡状态的有关计算
本题难度:困难
2、选择题 相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器
编号
| 起始时各物质的物质的量/mol
| 达到平衡时体
系能量的变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量:23.15 kJ
|
②
| 0.9
| 2.7
| 0.2
| 放出热量:Q
|
?
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
参考答案:C
本题解析:对于给定反应,平衡常数只是温度的函数,温度相同,平衡常数相同,A正确。由①中放出的热量,可知参加反应的N2为0.25 mol,则有
? N2(g)+3H2(g) 2NH3(g)
2NH3(g)
n(始)/mol 1 3 0
n(变)/mol? 0.25? 0.75? 0.5
n(平)/mol? 0.75? 2.25? 0.5
则①中NH3的体积分数为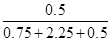 =
= ,由于①和②中建立的平衡是相同的,所以两容器中NH3的体积分数均为
,由于①和②中建立的平衡是相同的,所以两容器中NH3的体积分数均为 ,B正确。①和②建立的是相同的平衡,②中N2转化0.15 mol,放出的热量为92.6 kJ/mol×0.15 mol=13.89 kJ,C不正确。若容器①体积为0.5 L,即反应体积增大,压强减小,平衡向逆反应方向移动,则平衡时放出的热量小于23.15 kJ,D正确。
,B正确。①和②建立的是相同的平衡,②中N2转化0.15 mol,放出的热量为92.6 kJ/mol×0.15 mol=13.89 kJ,C不正确。若容器①体积为0.5 L,即反应体积增大,压强减小,平衡向逆反应方向移动,则平衡时放出的热量小于23.15 kJ,D正确。
本题难度:一般
3、简答题 一定温度下可逆反应2A?B+C达到平衡状态.请回答下列问题:
(1)若温度升高,平衡向正反应方向移动,则逆反应是______反应(填“放热”或“吸热”).
(2)若B为固体,降低压强平衡向逆反应方向移动,则A的状态是______(填写“固态”、“液态”或“气态”,下同).
(3)若A是气态时,加压时,平衡不移动,则B的状态是______,C的状态是______.
参考答案:(1)升高温度平衡向吸热反应的方向移动,说明正反应吸热,则逆反应放热,故答案为:放热;
(2)若B为固体,降低压强平衡向逆反应方向移动,应向气体物质的量增大的方向移动,则A应为气体.
故答案为:气态;
(3)若A是气态时,加压时,平衡不移动,说明反应物气体的化学计量数之和等于生成物气体的化学计量数之和,则B、C都为气体才符合,故答案为:气态;气态.
本题解析:
本题难度:一般
4、简答题 TDI、MDI等精细化工使用的H2可以通过天然气来制取,其生产流程如图1:
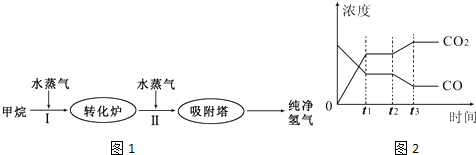
(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),100℃时,将1molCH4和2molH2O(g)通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=______.
(2)此流程的第II步反应:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
从上表可以推断:该反应是______反应(填“吸热”或“放热”).若该反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol/L,反应达到平衡时,CO的转化率为______.如图2表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件引起浓度变化的情况,如图2中t2时刻发生改变的条件是______(写出一种).
参考答案:(1)100℃时,将1molCH4和2molH2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 0.01 0.02 0 0
变化量(mol/L) 0.0050.005 0.005 0.015
平衡量(mol/L) 0.005 0.015 0.005 0.015
化学平衡常数K=c(CO).c3(H2)c(CH4).c(H2O)=0.005×(0.015)30.005×0.015=2.25×10-4 ,故答案为:2.25×10-4 ;
(2)随着温度的升高,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应;
设CO的转化率为x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始0.02mol/L 0.02mol/L 00
反应0.02xmol/L 0.02xmol/L 0.02xmol/L0.02xmol/L
平衡0.02(1-x)mol/L0.02(1-x)mol/L 0.02xmol/L 0.02xmol/L
化学平衡常数K=0.02x×0.02x[0.02×(1-x)]2=9,x=75%;
在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现,
故答案为:放热;75%;降低温度或增加水蒸气的量或减少氢气的量.
本题解析:
本题难度:一般
5、填空题 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
则甲烷直接将NO2还原为N2的热化学方程为 。
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g)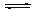 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。
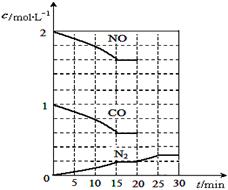
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
参考答案:(1)CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1(2分)
(2)k=" 5/144" 或0.0347 (2分); 不(1分); ② (1分)
(3) N2H4 +HNO2==HN3 + 2H2O(2分)
本题解析:(1)根据盖斯定律,甲烷直接将NO2还原为N2的?H=1/2?H1+1/2?H2=-867kJ·mol-1,所以热化学方程式为:CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
(2)根据图中所示浓度可知c(CO2)=0.4mol/L,则
K=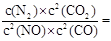
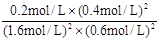 =
=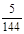
再向容器中充入CO、N2各0.6mol, Q仍为 5/144,所以平衡不移动;20min时,从图中看出平衡正向移动,N2起始浓度没变,所以选②。
(3) 根据氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,可求得分子式为HN3,该反应的化学方程式为:N2H4 +HNO2==HN3 + 2H2O
考点:本题考查热化学方程式的书写、平衡常数、平衡移动、化学方程式的书写。
本题难度:困难