微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  ?2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
?2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2 ;②NO2生成速率与NO2消耗速率相等;
③烧瓶内气体的压强不再变化;?④烧瓶内气体的质量不再变化;
⑤NO2的物质的量浓度不再改变;?⑥烧瓶内气体的颜色不再加深;
⑦烧瓶内气体的平均相对分子质量不再变化?⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦
B.①④⑧
C.只有①④
D.只有⑦⑧
参考答案:A
本题解析:①N2O4的消耗速率与NO2的消耗速率之比为1:2 ①错误。BC错误。②NO2生成速率与NO2消耗速率相等,②正确。④烧瓶内气体的质量不再变化,质量一直保持不变,不能作为判断平衡状态的依据,④错误。物质的量的总量和压强可以作为判断平衡状态的依据。③⑥⑦正确。⑧烧瓶内气体的密度不再变化,m、v不变密度也一直不变,⑧错误。BCD错误。
本题难度:一般
2、选择题 在密闭容器中进行如下反应:X2(气)+Y2(气)?2Z(气),已知X2、Y2、Z的起始浓度分别为0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是( ? )
A.Z为0.3mol/L
B.Y2为0.35mol/L
C.X2为0.2mol/L
D.Z为0.4mol/L
参考答案:AB
本题解析:
本题难度:简单
3、填空题 (12分)在一定条件下,存在如下反应:2SO2(g)+ O2 (g)  ?2SO3(g);ΔH<0
?2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K= ?
(2)升高温度,该反应K值?,SO2转化率?,正反?
应速率?(填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是?
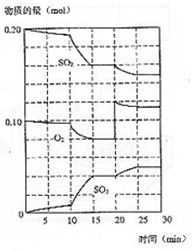
(4)据图判断,反应进行至20min时,曲线发生变化的原因?
是___________________(用文字表达),10min到15min的曲线变化的原因可能是?(填编号)。?
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量