微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):?CO(g)+2H2(g) CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.
CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.
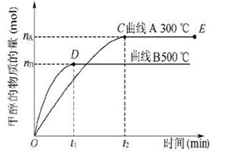
A.在300 ℃条件下,t1时刻该反应达到化学平衡
B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L
C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小
D.由图像说明该反应的正反应为放热反应
参考答案:D
本题解析:根据图像可知,在300℃条件下,t1时刻物质的浓度还是在变化的,所以该反应没有达到化学平衡,选项A不正确;温度为500℃时,从反应开始到平衡,生成甲醇的物质的量为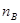 mol,此时甲醇的浓度为
mol,此时甲醇的浓度为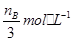 ,所以生成甲醇的平均速率为:v(CH3OH)=
,所以生成甲醇的平均速率为:v(CH3OH)= ?mol·L-1·min-1。因为反应速率之比是相应的化学计量数之比,所以氢气的反应速率是
?mol·L-1·min-1。因为反应速率之比是相应的化学计量数之比,所以氢气的反应速率是 ?mol·L-1·min-1,选项B不正确;在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,平衡向正反应方向进行,但氢气的浓度仍然是增加的,选项C不正确;由图像可知B曲线先得到平衡,温度高平衡时甲醇的物质的量反而低,说明正反应是放热反应,即升高温度平衡向逆反应方向移动,不利于甲醇的生成,所以选项D正确,答案选D。
?mol·L-1·min-1,选项B不正确;在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,平衡向正反应方向进行,但氢气的浓度仍然是增加的,选项C不正确;由图像可知B曲线先得到平衡,温度高平衡时甲醇的物质的量反而低,说明正反应是放热反应,即升高温度平衡向逆反应方向移动,不利于甲醇的生成,所以选项D正确,答案选D。
本题难度:一般
2、填空题 现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
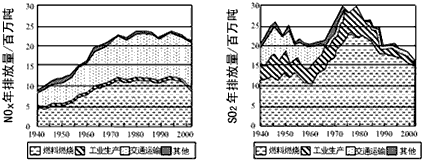
(1)结合上图数据,判断下列说法正确的是______。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量下降,主要是减少了燃烧的煤的量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:____________________。
(3)汽车排放的尾气中含有未燃烧充分的碳氢化合物以及N2、CO2、NO、CO等。有人设计利用反应
2NO+2CO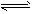 N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表

在上述条件下反应能够自发进行,则反应的△H_____0(“>”、“<”或“=”)。前2h内的平均反应速率v(N2)=______。据此你认为将该反应从理论转化为现实的最重要的研究方向是______________。
(4)某次降雨过程收集到10 L的雨水,向雨水中滴加1 mL 6 mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4 mol/L,再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为
0. 1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请写出将H2O2加入到雨水中与含硫化合物反应的离子方程式______________,并计算排放到空气中的NOx和SO2的物质的量之比接近于_______。
参考答案:(1)BD
(2)CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
(3)<;1.875×10-4 mol·L-1·h-1;寻找高效的催化剂
(4)H2O2+SO2=2H++SO42-;1:1
本题解析:
本题难度:一般
3、填空题 (13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡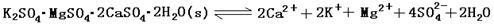
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
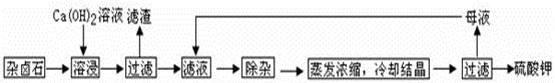
(1)滤渣主要成分有?和?以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:?。
(3)“除杂”环节中,先加入?溶液,经搅拌等操作后,过滤,再加入?溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,?
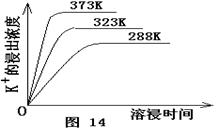
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5?,求此温度下该反应的平衡常数K?。
参考答案:(1)CaSO4(1分) Mg(OH)2(1分)
(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。(2分)
(3)K2CO3 (2分)?H2SO4 (2分)
(4)①③(2分)
(5)K=1.75×104(3分)
本题解析:(1)根据题目给出的可逆溶解平衡,加Ca(OH)2后,Mg 2+变成Mg(OH)2,硫酸钙是微溶物,因此滤渣成分是Mg(OH)2,CaSO4和未溶杂卤石;(2)根据勒夏特列原理,加入Ca(OH)2后,Mg 2+不断沉淀,硫酸钙也析出,平衡正移,因此浸出K+;(3)为了使生成的硫酸钾最纯,要除去加入的过量的氢氧化钙,而进入杂质阳离子,因此加入碳酸钾,最后硫酸钾除去过量的碳酸钾且调节溶液pH值;(4)由已知曲线图观察可知,升高温度可以提高K+浸出率,缩短浸出时间;(5)由题意知:Ksp(CaCO3)=2.80×10-9=c(Ca2+)·c(CO32-),Ksp(CaSO4)=4.90×10-5=c(Ca2+)·c(SO42-),因此有:Ksp =1.75×104。
点评:本题在化学工艺流程的背景下对化学反应平衡进行考查,题目难度比较大,综合性较强。
本题难度:一般
4、选择题 实验测得鲜牛奶在30 ℃时6小时变质,该反应温度每升高10 ℃时反应速率增大一倍,现将鲜牛奶放在冰箱的冷藏室里,保鲜期延长为48小时,则该冰箱的冷藏室里的温度为(?)
A.-20 ℃
B.-10 ℃
C.0 ℃
D.10 ℃
参考答案:C
本题解析:将牛奶放在冰箱里,保鲜期比30 ℃条件下增大了 =8倍,则牛奶变质的反应速率应降低8倍。设30 ℃时牛奶的变质速率为v,t ℃时,牛奶变质速率为
=8倍,则牛奶变质的反应速率应降低8倍。设30 ℃时牛奶的变质速率为v,t ℃时,牛奶变质速率为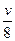 。根据题意v·
。根据题意v·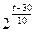 =
= ?v,则t="0" ℃。选C。
?v,则t="0" ℃。选C。
本题难度:一般
5、选择题 在一定温度下,反应

 的平衡常数为9。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
的平衡常数为9。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.10%
B.18%
C.20%
D.40%
参考答案:B?
本题解析:反应

 的平衡常数为9。因此
的平衡常数为9。因此


 的平衡常数为
的平衡常数为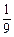 。
。 ,设
,设
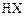 转化的物质的量为mol,则有
转化的物质的量为mol,则有 =
=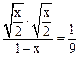 ,解得
,解得
x=0.12mol,则在该温度时HX(g)的最大分解率接近于18%。
本题难度:简单